题目内容
下列基态原子的外围电子排布式中错误的是( )
| A、K+ 1s2 2s2 2p6 3s23p6 | B、F 1s22s22p5 | C、S2- 1s22s22p6 3s2 3p4 | D、Ar 1s2 2s2 2p6 3s23p6 |
分析:基态原子或离子的电子应处于能量最低的状态,结合能量最低原理解答.
解答:解:A.K+电子排布式为1s22s22p63s23p6,符合能量最低原理,故A正确;
B.F电子排布式为1s22s22p5,符合能量最低原理,故B正确;
C.S2-核外有18个电子,其电子排布式为1s22s22p63s23p6,故C错误;
D.Ar电子排布式为1s22s22p63s23p6,符合能量最低原理,故D正确;
故选C.
B.F电子排布式为1s22s22p5,符合能量最低原理,故B正确;
C.S2-核外有18个电子,其电子排布式为1s22s22p63s23p6,故C错误;
D.Ar电子排布式为1s22s22p63s23p6,符合能量最低原理,故D正确;
故选C.
点评:本题考查原子核外电子排布,题目难度不大,本题注意基态原子或离子的电子排布规律,把握书写方法.

练习册系列答案
相关题目
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | | | |||||||||||||||
| | | | | b | c | d | | | |||||||||
| e | | | f | | | | | ||||||||||
| | | | | | | | g | | | | | | | | | | |
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
|
a |
|
|
|||||||||||||||
|
|
|
|
|
b |
c |
d |
|
|
|||||||||
|
e |
|
|
f |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
|
|
|
|
请回答下列问题:
(1)用电子式描述a~g中电负性最大和最小的元素形成化合物的过程:
。
(2)c的单质的结构式为: ,已知互为等电子体的分子具有相似的价键结构,写出由上述元素组成与c的单质互为等电子体的电子式(任一种): 。
(3)g元素在周期表中的位置是第四周期, 族,该元素在周期表分区中属于 区;写出g的基态原子的外围电子排布式: 。
(4)分别由a、b、d、f元素形成的单质晶体的熔沸点由高到低顺序为(用单质的化学式表示): 。
(5)写出由a、b、c、d元素组成,原子个数比为5∶1∶1∶3的化合物与足量烧碱溶液反应的离子方程式: 。
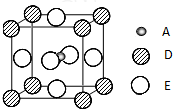 (2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.
(2010?泰州三模)已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大.A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2-离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2.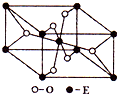 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B二种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.