题目内容
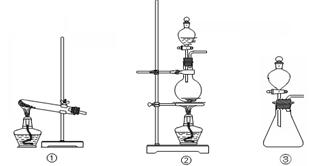
( 10分)“84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4 Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
(1)从①、②、③装置中选择合适的制气装置(A处)___________ (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________说明该装置存在明显的缺陷,请提出合理的改进的方法_______________________________
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式 ______________________________________
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 __________________________
(1)② (2分)(2)产生的氯气中含有水蒸气会反应生成次氯酸(2分)
在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置)(2分)
(3)Cl2 + SO32—+ H2O = SO42— + 2Cl—+ 2H+(2分) (4)HCl(或盐酸)(2分)
解析试题分析:(1)根据制取氯气的方程式可知,该反应是固体和液体反应制取气体的,因此选择的装置应该是②。
(2)由于产生的氯气中含有水蒸气,会和氯气反应生成次氯酸,次氯酸具有漂白性,使布条褪色。因此要防止该现象的发生,在需要干燥氯气,所以合理的改进方法是在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置)。
(3)氯气能把亚硫酸钠氧化生成硫酸钠,反应的离子方程式是Cl2 + SO32—+ H2O = SO42— + 2Cl—+ 2H+。
(4)由于酸性强弱顺序是盐酸>碳酸>次氯酸,所以根据较强的酸制取较弱的酸以及生成的CO2可知,反应中一定有盐酸生成,但不能确定是否有次氯酸生成。
考点:考查氯气的制备、氯气性质检验等
点评:该题主要是围绕着氯气的制备、性质检验,重点考查学生的实验基本操作的规范性和准确性,及灵活运用知识解决实际问题的能力。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案




 Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
