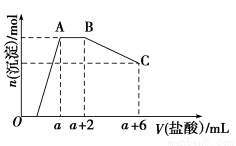
题目内容
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________;
(2)实验③中的现象为_____________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________、________。
(1)PbO2>KMnO4>H2O2
(2)溶液紫红色褪去,有白色沉淀生成
(3)2MnO4—+5H2O2+6H+=2Mn2++5O2↑+8H2O
5PbO2+2Mn2++4H+=5Pb2++2MnO4—+2H2O
【解析】实验①说明H2O2能被MnO4—氧化,氧化性:KMnO4>H2O2;实验②说明Mn2+能与PbO2反应生成MnO4—,氧化性:PbO2>KMnO4。实验③中SO2还原性较强,能使酸性KMnO4褪色,SO2被氧化为H2SO4,H2SO4和Pb2+反应生成PbSO4白色沉淀。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂:0.01 mol/L酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有________中的一种或两种。
| 实验操作 | 预期现象 | 结论 |
验证猜想Ⅰ | 步骤①:取少量0.01 mol/L酸性KMnO4溶液,滴入所得溶液 |
|
|
步骤②:________ |
| 含有Fe3 | |
验证猜想Ⅱ | 将所得气体通入如下装置 |
| 含有两种气体 |
【实验探究】
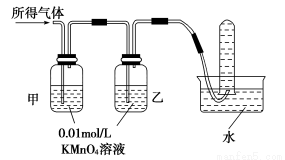
【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,判断该方法是否正确并进行评价:_____________________________