题目内容
【题目】下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:
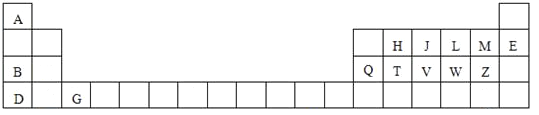
(1)原子半径最大的元素是 _____;在化合物中只有负价的元素是 ______;属于副族元素是____;适合作半导体材料的是____,(只用表中的字母填写)
(2)V在周期表中的位置第____周期第______族.
(3)A与M元素形成的化合物是______化合物,D与Z原子形成的化学键是____键;
(4)J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是___________________________________;(用化学式表示)
(5)L元素形成的氢化物的在-4℃时是__________晶体(填晶体类型),其密度比对应的液态还小,呈固体而非气体的原因是____________________________________。
(6)写出B、Q两种元素的氧化物对应的水化物相互反应的化学方程式_________________________________________________________________。
【答案】 D M G T 三 VA 共价 离子 HNO3>H2CO3>H2SiO3(或H4SiO4) 分子 分子之间还能产生氢键 NaOH+Al(OH)3= NaAlO2+2H2O
【解析】本题分析:本题主要考查元素的性质。根据元素在周期表中的分布,可以确定A是氢,B是钠,D是钾,G是钪,H是碳,J是氮,L是氧,M是氟,E是氖,Q是铝,T是硅,V是磷,W是硫,Z是氯。
(1)原子半径最大的元素是左下角的D(K);在化合物中只有负价的元素是右上角的M(F);属于副族元素的是中间的G(Sc);适合作半导体材料的是T(Si)。
(2)从上述表中可以看出V在周期表中的位置是第三周期第VA族。
(3)H、F都是非金属元素,A与M元素形成的化合物是共价化合物,钾是活泼金属,Cl是活泼非金属,D与Z原子形成的化学键是离子键。
(4)非金属性J>H>T,J、H、T三种元素的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(或H4SiO4)。
(5)L元素形成的氢化物水在-4℃时形成冰,冰是分子晶体,其密度比对应的液态水还小,呈固体而非气体的原因是水分子之间产生氢键。
(6)B、Q两种元素的氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3= NaAlO2+2H2O。


