题目内容
15.某二价金属A与稀硝酸反应时,A与硝酸所消耗的物质的量比为2﹕5,则硝酸被还原的产物可能是( )| A. | NO | B. | NO2 | C. | N2O3 | D. | NH4NO3 |
分析 生成二价金属硝酸盐时HNO3未被还原,参加反应的二价金属与消耗的硝酸的物质的量之比为2:5时,设物质的量分别为2mol、5mol,结合原子守恒和电子守恒来计算.
解答 解:生成二价金属硝酸盐时HNO3未被还原,参加反应的二价金属与消耗的硝酸的物质的量之比为2:5时,设物质的量分别为2mol、5mol,则二价金属硝酸盐时未被还原HNO3的物质的量为4mol,
设硝酸的还原产物中N元素的化合价为n,若被还原的硝酸的物质的量为5mol-4mol=1mol,
由电子守恒可知,2mol×(2-0)=1mol×(5-n),解得n=+1,NH4NO3中氮的平均化合价为+1,故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中电子守恒和原子守恒的应用为解答的关键,侧重分析与计算能力的考查,选项D易漏选,题目难度中等.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
5.氯化亚铜(CuCI)是有机合成工业中应用较广泛的催化剂,微溶于水,不溶于乙醇.工业上以废旧铜为原料生产氯化亚铜的流程如下:
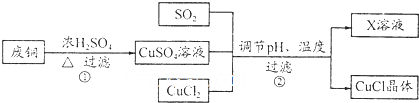
(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
(3)析出的CuCl晶体不用水而用乙醇洗涤的目的是CuCl不溶于乙醇,微溶于水,可减少晶体损失,且乙醇易挥发,利于干燥.
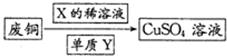
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).
方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).

(l)写出过程①的主要化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)分析下表,析出CuCl晶体时的最佳pH为2;当pH较大时,CuCI晶体产率较低,其原因是pH增大,Cu2+水解损失增加.
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率(%) | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(4)为了更好体现绿色化学思想,有人提出如下方案:方案一:可将上述X稀溶液用于废铜的处理(如图所示),则Y可以为O2(填化学式).

方案二:①中Cu与浓H2SO4反应所得SO2和CuSO4用于②中CuCl的制备,理论上不需要(“需要”或“不需要”)另外补充SO2,原因是反应①Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O中生成的CuSO4和SO2的物质的量之比为1:1,而反应②CuSO4+CuCl2+SO2+2H2O═2Cucl↓+2H2SO4需要的CuSO4和SO2的物质的量之比也恰好为1:1,所以理论上不需要补充SO2(结合化学方程式回答).
6.如果取一块冰放在容器里,不断地升高温度,可以实现:“冰→水→水蒸气→氢气和氧气”的变化,在各步变化时破坏的粒子间的主要相互作用依次是( )
| A. | 氢键、极性键、非极性键 | B. | 氢键、氢键、极性键 | ||
| C. | 氢键、氢键、非极性键 | D. | 氢键、非极性键、极性键 |
3.下列实验操作或装置正确的是( )
| A. | 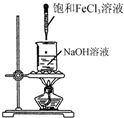 制备氢氧化铁胶体 | B. | 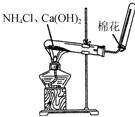 制取NH3 | ||
| C. | 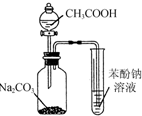 证明H2CO3酸性强于苯酚 | D. | 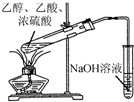 制备乙酸乙酯 |
10.化学知识在生产和生活中有着重要的应用,下列说法中不正确的是( )
| A. | 大力推广使用太阳能、风能等清洁能源,能减少PM2.5的污染 | |
| B. | 将燃煤通过气化和液化等物理变化可以减少污染,提高燃烧效率 | |
| C. | 发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔 | |
| D. | 金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火 |
20.下列电离方程式错误的是( )
| A. | Al2(SO4)3=2Al3++3SO42- | B. | Na2CO3=Na++CO32- | ||
| C. | Ba(OH)2=Ba2++2 OH- | D. | NaHSO4=Na++H++SO42- |
7.已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入4mol SO2和1mol O2充分反应,最终放出的热量为( )
| A. | =393.28 kJ | B. | =196.64 kJ | C. | <196.64 kJ | D. | >196.64 kJ |
4.下列各组离子在溶液中可大量共存的是( )
| A. | K+,Cl-,CO32-,Na+ | B. | H+,Ba2+,Fe3+,S2- | ||
| C. | NH4+,SO42-,K+,OH- | D. | H+,NO3-,Na+,SiO32- |
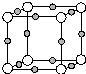 X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题:
X、Y、Z、Q、W、N核电荷数依次增大的六种元素中,Y原子核外的L层电子数是K层的两倍,Q原子核外的L层中只有两个未成对电子,X与Y、Q可以以原子个数2:1或1:1形成化合物.W与Q同主族,元素N的第三能层共有5对成对电子.请回答下列问题: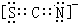 ;
;