题目内容
(15分)乙醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)?△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g)? △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g))? △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的?△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
(1)C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;
(2) -45.5 污染小,腐蚀性小等;(3)①K=0.07(MPa)-1; ②P1< P2< P3< P4;反应分子数减少,相同温度下,压强升高,乙烯转化率提高; ③将产物乙醇液化转移去,增加n(H2O):n(C2H4)的比。
解析试题分析:(1)根据题意可得乙烯与浓硫酸反应生成硫酸氢乙酯C2H5OSO3H的方程式:C2H4+H2SO4= C2H5OSO3H; C2H5OSO3H+H2O=C2H5OH+ H2SO4;(2)①-②-③,整理可得C2H4 (g)+H2O(g)=C2H5OH(g),△H=(-23.9+29.1-50.7)KJ/mol=-45.5 KJ/mol;与间接水合法相比,气相直接水合法的优点是污染小,腐蚀性小等;(3)①乙烯水合制乙醇反应在图中A点的平衡常数K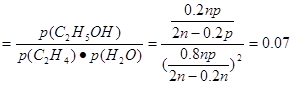 (MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
(MPa)-1; ②在相同的温度下由于乙烯是平衡转化率是P1< P2< P3< P4;由方程式C2H4 (g)+H2O(g)=C2H5OH(g)可知该反应的正反应是气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是:P1< P2< P3< P4; ③若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有改变物质的浓度,如从平衡体系中将产物乙醇分离出去,或增大水蒸气的浓度,改变二者的物质的量的比等等。
考点:考查化学方程式的书写、压强对平衡移动的影响、物质制取方案的设计与比较、反应热的计算、化学平衡常数的计算及提高产品产率的方法的探究的知识。

I.(1)在一密闭的2L的容器里充入8mol SO2和4mol 18O2,在一定条件下开始反应:2SO2(g)+O2(g) 2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
2SO3(g),2min末测得容器中有7.2mol SO2。试回答:
① 反应后18O原子存在于哪些物质中 ;
② 2min末SO3的浓度________________________;
③ 用O2的浓度变化表示该时间段内的化学反应速率_______________________。
II.某化学反应2A (g) B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 3 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1) 实验1达到平衡的时间是__________min,c2_____1.0 min·L-1(填“<”“>”或“=”)。
(2)实验3比实验1的反应速率_________(填“快”或“慢”),原因是___________________________________________________________________________。
(3) 如果2A (g)
 B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。
B(g)+D(g)是一个吸热反应,那么实验3与实验1相比,在相同体积时___________吸收的热量多,理由是___________________________________________。 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
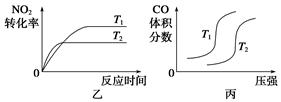
①恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是________(填序号);
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);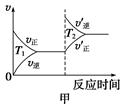
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________;平衡时,甲容器中CO的转化率= ;
②平衡时,比较下列容器中CO的转化率:乙 甲(填“>”、“=”或“<”,下同);丙 甲。
(10分)某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)="4.5" mol·L-1,反应均需要搅拌60min。
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量 /g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184 |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5 mL0.01 mol·L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
为了获得铝粉溶解量,还需要测量的数据是 。
(2)实验①和③是为了研究硫酸的浓度对该反应的影响,则t1= ℃,V1= mL。
(3)实验③和④是为了研究加入CuSO4溶液对该反应的影响,则t2= ℃,V2= mL。
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是 。
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
| 反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
| 4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
| 4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
| 实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
| ② | | | | |
| ③ | | | | |
| ④ | | | |
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质 量/g | 金属 状态 | c(H2SO4)/ (mol·L-1) | V(H2SO4) /mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉 末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉 末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,完成下列问题:
(1)实验4和5表明________________对反应速率有影响,________反应速率越快,能表明同一规律的实验还有________。(填实验序号)
(2)仅表明反应物浓度对反应速率产生影响的实验有________。(填实验序号)
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:
_____________________________________________
 CO(g)+H2(g);
CO(g)+H2(g); H2(g)+CO2(g)。
H2(g)+CO2(g)。 2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。
2NH3(g),ΔH<0,测得压强-时间图像如图甲,测得p2=0.6p1,此时温度与起始温度相同,在达到平衡前某一时刻(t1)若仅改变一种条件,得到如乙图像。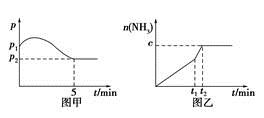
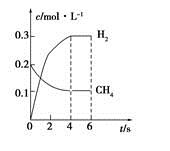
 CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。
CO(g)+3H2(g)制备CO和H2。在一定条件下1 L的密闭容器中充入0.3 mol H2O和0.2 mol CH4,测得H2(g)和CH4(g)的物质的量浓度随时间变化曲线如右图所示:0~4 s内,用CO(g)表示的反应速率为____________。 xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,C的平均反应速率是0.1 mol/(L·min)。求: