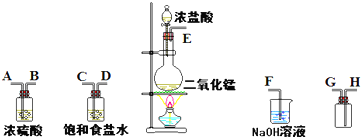
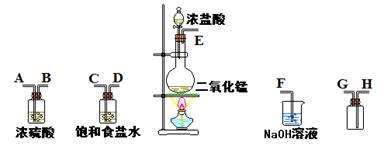
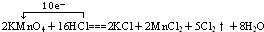题目内容
实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O
(1)该反应的氧化剂是______,氧化产物是______,电子转移方向和数目可表示为______.
(2)浓盐酸在反应中显示出来的性质是______(填写编号,多选倒扣分).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)若用足量的浓盐酸与一定量的二氧化锰反应,产生的氯气在标准状况下的体积为11.2L,则反应中被氧化的HCl的质量为多少?
【答案】分析:(1)从元素化合价变化的角度分析,氧化剂在反应中得到电子被还原,元素的化合价降低,还原剂被氧化,得到产物为氧化产物;
(2)浓盐酸在反应中表现为还原性和酸性;
(3)反应方程式为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,根据方程式计算.
MnCl2+Cl2↑+2H2O,根据方程式计算.
解答:解:(1)化合价升高元素是氯元素,在反应中共失去电子,得到的氧化产物为Cl2,化合价降低元素是锰元素,在反应中共得到电子,被还原,KMnO4为氧化剂,氧化还原反应中转移的电子数目为10,则有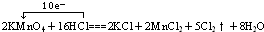 ,
,
故答案为:KMnO4;Cl2;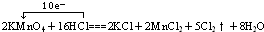 ;
;
(2)根据方程式可知当有16molHCl参加反应时,有10molHCl被氧化,6molHCl表现为酸性,生成氯化物,故答案为:②;
(3)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 被氧化HCl
MnCl2+Cl2↑+2H2O 被氧化HCl
22.4L 73g
11.2L m
m=36.5g,
答:反应中被氧化的HCl的质量为36.5g.
点评:本题考查氧化还原反应,题目难度中等,注意元素化合价的判断,为解答该题的关键,本题易错点为反应的计算问题,注意化学方程式的书写.
(2)浓盐酸在反应中表现为还原性和酸性;
(3)反应方程式为MnO2+4HCl(浓)
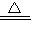 MnCl2+Cl2↑+2H2O,根据方程式计算.
MnCl2+Cl2↑+2H2O,根据方程式计算.解答:解:(1)化合价升高元素是氯元素,在反应中共失去电子,得到的氧化产物为Cl2,化合价降低元素是锰元素,在反应中共得到电子,被还原,KMnO4为氧化剂,氧化还原反应中转移的电子数目为10,则有
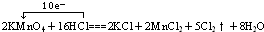 ,
,故答案为:KMnO4;Cl2;
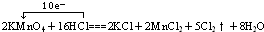 ;
;(2)根据方程式可知当有16molHCl参加反应时,有10molHCl被氧化,6molHCl表现为酸性,生成氯化物,故答案为:②;
(3)MnO2+4HCl(浓)
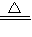 MnCl2+Cl2↑+2H2O 被氧化HCl
MnCl2+Cl2↑+2H2O 被氧化HCl22.4L 73g
11.2L m
m=36.5g,
答:反应中被氧化的HCl的质量为36.5g.
点评:本题考查氧化还原反应,题目难度中等,注意元素化合价的判断,为解答该题的关键,本题易错点为反应的计算问题,注意化学方程式的书写.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目