题目内容
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解
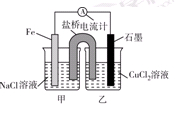
质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液的电解实验,如图所示。
回答下列问题:
(1)甲烷燃料电池正极的电极反应式为 、负极的电极反应式为 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 ;若电解一段时间后,石墨棒上产生标准状况下的Cl2 224 mL,电解后的溶液总体积为200 mL,则溶液的pH = 。
(3)若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (法拉第常数F = 9.65×l04C· mol-1,列式计算),最多能产生的氯气体积为 L (标准状况)。
(1)2O2+8e-+4H2O = 8OH-,CH4-8e-+10OH-= CO32-+7H2O(各2分)
(2)H2(1分) 2NaCl+2H2O 2NaOH+H2↑+Cl2↑(1分) 13(1分)
2NaOH+H2↑+Cl2↑(1分) 13(1分)
(3)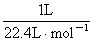 ×8×9.65× 104C·mol-1=3.45× 104C 4(各2分)
×8×9.65× 104C·mol-1=3.45× 104C 4(各2分)
解析试题分析:甲烷燃料电池中燃料甲烷作负极,氧气作正极,电解质溶液为碱性,负极失电子发生氧化反应,电极反应式为CH4-8e-+10OH-= CO32-+7H2O,正极得电子发生还原反应,电极反应式为2O2+8e-+4H2O = 8OH-,a极是阳极,b极是阴极,2NaCl+2H2O 2NaOH+H2↑+Cl2↑,阴极产物有氢气和NaOH,阳极产物是氯气,产生氯气0.01摩尔,有方程式可知,NaOH的物质的量为0.02摩尔,C(OH-)=0.1mol/L,pH =13;若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上通过电解池的电量,1摩尔甲烷转移8摩尔电子,因此
2NaOH+H2↑+Cl2↑,阴极产物有氢气和NaOH,阳极产物是氯气,产生氯气0.01摩尔,有方程式可知,NaOH的物质的量为0.02摩尔,C(OH-)=0.1mol/L,pH =13;若每个电池甲烷通入量为 1 L(标准状况),且反应完全,则理论上通过电解池的电量,1摩尔甲烷转移8摩尔电子,因此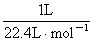 ×8×9.65× 104C·mol-1=3.45× 104C ,生成1摩尔氯气需要转移2摩尔电子,因此,1升甲烷最多可以制的4升氯气。
×8×9.65× 104C·mol-1=3.45× 104C ,生成1摩尔氯气需要转移2摩尔电子,因此,1升甲烷最多可以制的4升氯气。
考点:考查原电池和电解池

 阅读快车系列答案
阅读快车系列答案A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | S 、OH- 、OH- |

(1) M为直流电源的 极,b电极上发生的电极反应为 。
(2)计算e电极上生成的气体在标准状况下的体积为 。
(3)写出乙烧杯中的总反应的离子方程式: 。
(4)要使丙烧杯中的C溶液恢复到原来的状态,需要进行的操作是(写出要加入的物质和质量) 。
电浮选凝聚法处理酸性污水的工作原理如图所示。下列说法不正确的是
A.铁电极的电极反应式为: |
B.通人空气的石墨电极的电极反应式为 |
| C.若左池石墨电极产生44. 8L(标准状况)气体,则消耗氧气0. 5mol |
| D.为增强污水的导电能力,可向污水中加入适量工业用食盐 |