题目内容
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.04mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
(1)①环形玻璃搅拌棒 (2分)②隔热、保温、减小实验过程中热量的损失 (2分)
③偏低 (2分) (2)①b (2分) ③当溶液由无色变为红色,且半分钟不褪色 (2分)
④0.096mol/L (2分) ⑤CD (2分)
解析试题分析:(1)①在实验过程中为了使溶液混合均匀,需要搅拌,所以从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌棒。
②由于在实验过程中要尽可能的减少热量的损失,所以大小烧杯之间填满纸屑的作用是隔热、保温、减小实验过程中热量的损失。
③醋酸是弱酸,存在电离平衡,电离是吸热的,所以若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低。
(2)①根据仪器的构造可知,a是酸式滴定管,b是碱式滴定管,因此应该用碱式滴定管盛放氢氧化钠溶液,答案选b。
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,由于碱能使酚酞试液变红色,所以当溶液由无色变为红色,且半分钟不褪色时即达到滴定终点。
④根据表中数据可知,三次实验消耗的氢氧化钠溶液的体积分别是24.04ml、23.96ml、22.52ml,显然第三次实验的误差太大,舍去。则消耗氢氧化钠溶液的平均值是24.00ml,所以盐酸的浓度是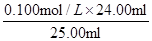 =0.096mol/L。
=0.096mol/L。
⑤根据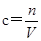 可知,滴定终点读数时,俯视滴定管的刻度,则读数偏小,测定结果偏低;选项B、E中对实验不影响;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,相当于氢氧化钠的体积增加,测定结果偏高;未用标准液润洗碱式滴定管,相当于稀释氢氧化钠溶液,所以消耗氢氧化钠溶液的体积增加,测定结果偏高,答案选CD。
可知,滴定终点读数时,俯视滴定管的刻度,则读数偏小,测定结果偏低;选项B、E中对实验不影响;滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液,相当于氢氧化钠的体积增加,测定结果偏高;未用标准液润洗碱式滴定管,相当于稀释氢氧化钠溶液,所以消耗氢氧化钠溶液的体积增加,测定结果偏高,答案选CD。
考点:考查中和热测定和酸碱中和实验的有关判断、仪器选择、数据处理和计算以及误差分析
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力。该类试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。该类试题的难点是误差分析。

(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。

①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:

①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
|
实验次数 |
起始滴定管读数 |
终点滴定管读数 |
|
1 |
0.00mL |
24.02mL |
|
2 |
0.50mL |
24.46mL |
|
3 |
2.50mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为 (保留小数点后3位)。
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
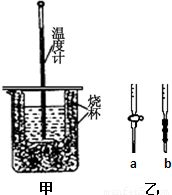
(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是______.
②大小烧杯之间填满纸屑的作用是______.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值______(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择______滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,______即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是______(填写字母序号).
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.滴定前锥形瓶用蒸馏水洗净后未干燥.
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.