题目内容
(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
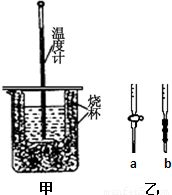
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。

①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:

①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
|
实验次数 |
起始滴定管读数 |
终点滴定管读数 |
|
1 |
0.00mL |
24.02mL |
|
2 |
0.50mL |
24.46mL |
|
3 |
2.50mL |
25.02mL |
测得未知稀盐酸的物质的量浓度为 (保留小数点后3位)。
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
(1)①环形玻璃搅拌棒 (2分)
②隔热、保温、减小实验过程中热量的损失 (2分)
③偏低 (2分)
(2)①b (2分)
③当溶液由无色变为红色,且半分钟不褪色 (2分)
④0.096mol/L (2分)
⑤CD (2分)
【解析】
试题分析:(1)①中和反应测定反应热时,需要搅拌,而由于有温度计,所以还需要环形搅拌器。②中和热测定需要隔热、保温,否则热量与外界进行交换后,测量值不准确。③由于醋酸为弱酸,电离吸热,所以中和热比原来偏低。(2)①碱式滴定管口为胶头,防止与氢氧化物发生反应。③滴定终点的现象为当溶液由无色变为红色,且半分钟不褪色。④计算三次平均所需氢氧化钠溶液的体积为23.5ml。待测盐酸的物质的量浓度=(0.0235×0.1)/0.025=0.096mol/L。⑤A中俯视刻度线,造成氢氧化钠体积读数偏小,盐酸浓度偏大。B中造成盐酸残留在瓶壁上未反应,盐酸浓度偏小。C氢氧化钠体积读数偏大,盐酸浓度偏大。D中造成氢氧化钠残留在瓶壁上未反应,盐酸浓度偏大。E不影响盐酸浓度。
考点:中和热测定,酸碱滴定
点评:本题考查的两个基本实验,难度不高,属于简单题。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.04mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是 (填写字母序号)。
A. 滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B. 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 未用标准液润洗碱式滴定管
E. 滴定前锥形瓶用蒸馏水洗净后未干燥
(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是______.
②大小烧杯之间填满纸屑的作用是______.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值______(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择______滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,______即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
⑤以下操作造成测定结果偏高的原因可能是______(填写字母序号).
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.未用标准液润洗碱式滴定管
E.滴定前锥形瓶用蒸馏水洗净后未干燥.
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.