��Ŀ����
����Ŀ���о����ʵĺϳɻ��Ʊ����л���ѧ������ѧ����Ҫ����֮һ��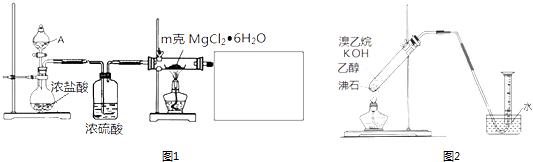
��1��ijʵ��С��̽��ʵ�����Ʊ���ˮ�Ȼ�þ�ķ����������ͼ1װ�âٷ�Һ©���е�A�����������Լ����ƣ���
��������ѧ�������������հ����ڲ�������ʵ��װ�� ��
��ѡ����Լ��У�A��ϡNaOH��Һ B����ˮ�Ȼ��� C��ϡ���� D��Ũ����
�ۼ���ʵ������� MgCl26H2O δˮ�⣬�����κ��Լ�����ķ�������MgCl26H2O �Ƿ���ȫת��ΪMgCl2 �� д��ʵ�鷽�� ��
��2��ʵ�����Ʊ����ռ�������ϩ���е�ͬѧͨ���Ҵ��Ʊ���ϩ��д����ػ�ѧ����ʽ�� ��
��ʵ����Ҵ��⣬������Լ�����Ʒ�������������������� ��
���е�ͬѧ̽�������Ʊ���ϩ�ķ������������ͼ2װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壮
�����������ʺܵ͵�ԭ����Ҫ�� ��
Ϊ����������ʣ�����ͼװ�õĻ����ϣ����һ��Ľ���ʩ�� ��
���𰸡�
��1��Ũ��� ���������ò���������������Ϊ
���������ò���������������Ϊ ![]() g��˵��MgCl2?6H2O��ȫת��ΪMgCl2 �� ����δ��ȫ
g��˵��MgCl2?6H2O��ȫת��ΪMgCl2 �� ����δ��ȫ
��2��CH3CH2OH ![]() CH2=CH2��+H2O��Ũ�������������Һ����ʯ�������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õ�
CH2=CH2��+H2O��Ũ�������������Һ����ʯ�������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õ�
���������⣺��1�������Ȼ�þ����ʧȥ�ᾧˮ�õ���ˮ�Ȼ�þ�������Ȼ�þ��ˮ�⣬Ӧ��HCl��Χ�м��ȷֽ⣬A��Һ��ΪŨ���ᣬ��Բ����ƿ��Ũ�����ϣ������������ȣ�����HCl�ݳ���ϴ��ƿ��Ũ�������HCl����������������Һ����β����HCl����ֹ��Ⱦ������ע���ֹ��������Ҫ��ֹ����������Һ��ˮ���������Ȼ�þˮ�⣬β������װ�������װ��֮����Ҫ����ʢ���Ȼ��Ƶĸ���ܣ���ʢ��Ũ�����ϴ��ƿ������������������֪����Һ©���е�A������Ũ���ᣬ���Դ��ǣ�Ũ�������������������Һ����β����HCl����ֹ��Ⱦ�������ҷ�ֹ��������Ҫ��β������װ�������װ��֮����Ҫ����ʢ���Ȼ��Ƶĸ���ܣ���ʢ��Ũ�����ϴ��ƿ������ֹ�Ȼ�þˮ�⣬��Ҫ��������ʵ��װ��Ϊ��  �ȣ� ���Դ��ǣ�
�ȣ� ���Դ��ǣ�  �ȣ���ʵ�������MgCl26H2Oδˮ�⣬mg��������ʵ���Ϊ
�ȣ���ʵ�������MgCl26H2Oδˮ�⣬mg��������ʵ���Ϊ ![]() mol����ȫ�ֽ�õ��Ȼ�þΪ
mol����ȫ�ֽ�õ��Ȼ�þΪ ![]() mol��95g/mol=
mol��95g/mol= ![]() g���������ò���������������Ϊ
g���������ò���������������Ϊ ![]() g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ�����Դ��ǣ��������ò���������������Ϊ
g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ�����Դ��ǣ��������ò���������������Ϊ ![]() g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ����2�����Ҵ���Ũ���������·�����ȥ��Ӧ������ϩ����Ӧ����ʽΪ��CH3CH2OH
g��˵��MgCl26H2O��ȫת��ΪMgCl2 �� ����δ��ȫ����2�����Ҵ���Ũ���������·�����ȥ��Ӧ������ϩ����Ӧ����ʽΪ��CH3CH2OH ![]() CH2=CH2��+H2O����Ӧ�лᷢ������Ӧ���ж�����̼�������������ɣ�������������Һ���ճ�ȥ������̼����������Һ�������Ҫ��ֹ���У�����Ҫ�����ʯ�����Ҵ��⣬������Լ�����Ʒ���������������У�Ũ���ᡢ����������Һ����ʯ�����Դ��ǣ�CH3CH2OH
CH2=CH2��+H2O����Ӧ�лᷢ������Ӧ���ж�����̼�������������ɣ�������������Һ���ճ�ȥ������̼����������Һ�������Ҫ��ֹ���У�����Ҫ�����ʯ�����Ҵ��⣬������Լ�����Ʒ���������������У�Ũ���ᡢ����������Һ����ʯ�����Դ��ǣ�CH3CH2OH ![]() CH2=CH2��+H2O��Ũ���ᡢ����������Һ����ʯ���ڷ��������������鷢����ȥ��Ӧ������ϩ������ͼ��װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壬˵��������ϩ���٣�������������ӷ���������ʺܵ͵�ԭ����Ҫ�ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�Ϊ����������ʣ�����������������װ�ã�������������������������������ˮԡ���ȣ����ڿ����¶ȵȣ�����������ӷ������Դ��ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õȣ�
CH2=CH2��+H2O��Ũ���ᡢ����������Һ����ʯ���ڷ��������������鷢����ȥ��Ӧ������ϩ������ͼ��װ���Ʊ���ϩ��ʵ��������Ͳ�ڱڸ��Ž϶���ɫ��״Һ�壬�ҵõ������������壬˵��������ϩ���٣�������������ӷ���������ʺܵ͵�ԭ����Ҫ�ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�Ϊ����������ʣ�����������������װ�ã�������������������������������ˮԡ���ȣ����ڿ����¶ȵȣ�����������ӷ������Դ��ǣ������¶ȹ��ߣ�����������ӷ���Ҳ�����������鷢������Ӧ�ȣ�������������װ�õȣ�

����Ŀ���о���������ѧ��Ӧ�������仯����H���뷴Ӧ���������ļ����йأ����ܿ��Լ�����Ϊ�Ͽ�1mol��ѧ��ʱ�������յ��������±��Dz��ֻ�ѧ���ļ������ݣ�
��ѧ�� | P��P | P��O | O=O | P=O |
����/kJmol��1 | 197 | 360 | 499 | X |
��֪����ȼ����Ϊ2378.0kJ/mol��������ȫȼ�յIJ���ṹ��ͼ��ʾ�����ϱ���X=kJmol��1 �� �� ��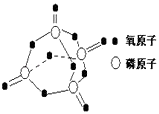
A.1057.5 kJmol��1
B.335.25 kJmol��1
C.433.75 kJmol��1
D.959.0 kJmol��1