题目内容
海洋是一个巨大的资源宝库,合理开发海洋资源对于实现可持续发展具有重要的战略意义。盐卤中除含有Mg2+、Cl-外,还含有少量Na+、Fe2+、Fe3+、SO42-和CO(NH2)2等。从海水提取食盐和Br2以后的盐卤中可以提取MgCl2、MgO、Mg(OH)2等物质,流程如下图所示

请回答下列问题:
(1)从MgCl2溶液得到MgCl2·6H2O晶体的过程中所需的基本操作有_________(填字母)。
A.加热蒸干 B.加热浓缩 C.冷却结晶 D.趁热过滤 E.过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是_____________。
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式 为:________________;加入NaClO的另一个作用是_____________。
(4) Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。已知:
①25℃时,Ksp[Mg(OH)2]=5.6×10-12;②Mg(OH)2(s)=MgO(g)+H2O(g) △H=+81.5kJ/mol。
①下列叙述正确的是_________。
A.从盐卤或海水中获得Mg(OH)2时,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成的MgO能覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
(1)从MgCl2溶液得到MgCl2·6H2O晶体的过程中所需的基本操作有_________(填字母)。
A.加热蒸干 B.加热浓缩 C.冷却结晶 D.趁热过滤 E.过滤洗涤
(2)制取无水氯化镁必须在氯化氢存在的条件下进行,原因是_____________。
(3)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式 为:________________;加入NaClO的另一个作用是_____________。
(4) Mg(OH)2是制镁盐、耐火材料和阻燃剂的重要原料。已知:
①25℃时,Ksp[Mg(OH)2]=5.6×10-12;②Mg(OH)2(s)=MgO(g)+H2O(g) △H=+81.5kJ/mol。
①下列叙述正确的是_________。
A.从盐卤或海水中获得Mg(OH)2时,工业上选择NaOH作沉淀剂
B.Mg(OH)2能作阻燃剂的原因是它分解吸热且生成的MgO能覆盖可燃物
C.可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁
②酸碱指示剂百里酚蓝变色的pH范围如下:
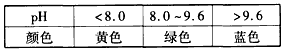
25℃时,在Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为____________。
(1)BCE
(2)防止Mg2+水解
(3)3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2=3NaCl+NaHCO3+N2↑+2H2O
;将Fe2+氧化为Fe3+,并形成Fe(OH)3而除去
(4)①B;②蓝色
(2)防止Mg2+水解
(3)3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2=3NaCl+NaHCO3+N2↑+2H2O
;将Fe2+氧化为Fe3+,并形成Fe(OH)3而除去
(4)①B;②蓝色

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
(I)多项选择题(6分)
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
(II)(14分)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。

(1)海水淡化工厂通常采用的制备淡水的方法有 (写出两种)。
(2)下图是从浓缩海水中提取溴
 的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是 。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是 。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是 。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g)
 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为 kg。
质量为 kg。 





 4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。
4
SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的质量为
kg。