题目内容
为了探究和验证氯气的性质,某研究性学习小组以MnO2和浓盐酸为主要原料,设计了如图所示装置(其中A是连有注射器针头的橡皮管,针头已插入并穿过橡皮塞)进行了研究.
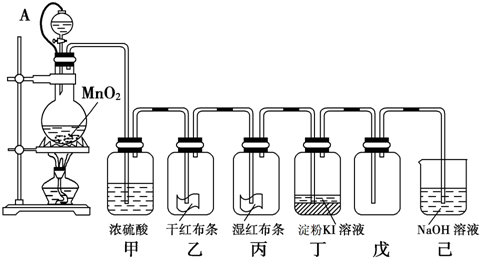
试回答下列问题:
(1)乙中的现象是
(2)橡皮管连通后,分液漏斗中的气体压强P1与烧瓶中的气体压强P2的关系为P1
(3)烧瓶内发生反应的化学方程式为
(4)已知氯气与冷水的反应为Cl2+H2O HCl+HClO.
HCl+HClO.
①你认为使有色布条退色的是什么物质?
②试用实验验证你的推论,写出假设、操作方法和推论.

试回答下列问题:
(1)乙中的现象是
干燥的红布条不褪色
干燥的红布条不褪色
,丙中的现象湿润的红布条褪色
湿润的红布条褪色
,丁中的现象是下层四氯化碳层呈紫红色
下层四氯化碳层呈紫红色
,(2)橡皮管连通后,分液漏斗中的气体压强P1与烧瓶中的气体压强P2的关系为P1
=
=
P2(填“>”、“<”或“=”),连接橡皮管的目的是有利于球形分液漏斗里浓盐酸顺利流入烧瓶里
有利于球形分液漏斗里浓盐酸顺利流入烧瓶里
;(3)烧瓶内发生反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
(4)已知氯气与冷水的反应为Cl2+H2O
 HCl+HClO.
HCl+HClO.①你认为使有色布条退色的是什么物质?
HClO
HClO
.②试用实验验证你的推论,写出假设、操作方法和推论.
分析:(1)次氯酸能使湿润的有色布条褪色,氯气能置换碘化钾中的碘,碘遇淀粉变蓝色,由此判断实验现象;
(2)根据针头的作用判断压强的大小,气体的压强有利于分液漏斗内的液体顺利流下;
(3)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰和水、氯气,注意稀盐酸和二氧化锰不反应;
(4)根据氯气和水反应的方程式判断存在的微粒,采用假设实验法排除推测是次氯酸.
(2)根据针头的作用判断压强的大小,气体的压强有利于分液漏斗内的液体顺利流下;
(3)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰和水、氯气,注意稀盐酸和二氧化锰不反应;
(4)根据氯气和水反应的方程式判断存在的微粒,采用假设实验法排除推测是次氯酸.
解答:解析:(1)利用图所示装置制备Cl2,制得的Cl2通过浓H2SO4(甲中)干燥Cl2,除去氯气中的水蒸气;Cl2与干红布条不反应(乙中),没有次氯酸生成,所以有色布条不褪色;Cl2与H2O反应生成的HClO起漂白作用,所以丙中红色布条褪色;Cl2与KI溶液反应生成I2单质,CCl4萃取碘单质,溶液分层(丁中)下层是I2的CCl4溶液,所以丁中的现象是下层四氯化碳层呈紫红色,故答案为:干燥的红布条不褪色;湿润的红布条褪色;下层四氯化碳层呈紫红色;
(2)利用针头连接后,分液漏斗与烧瓶内气压相等,有利于液体流下,故答案为:=;有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(3)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、水和氯气,反应方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
(4)①次氯酸能使湿润的有色布条褪色,故答案为:HClO;
②假设:氯气或盐酸或HClO使有色布条褪色.
实验验证方法:a.干燥的Cl2不能使干燥的有色布条褪色,说明Cl2本身没有漂白作用;
b.在干燥的有色布条上滴加盐酸,结果没有褪色现象,说明盐酸及水没有漂白作用;
c.在干燥的有色布条上滴加新制氯水,结果有色布条褪色;
推论:在氯水中存在反应:Cl2+H2O?HCl+HClO,说明HClO有漂白作用;
答:假设:氯气或盐酸或HClO使有色布条褪色;
实验验证方法:a.干燥的Cl2不能使干燥的有色布条褪色,说明Cl2本身没有漂白作用;
b.在干燥的有色布条上滴加盐酸,结果没有褪色现象,说明盐酸及水没有漂白作用;
c.在干燥的有色布条上滴加新制氯水,结果有色布条褪色;
推论:在氯水中存在反应:Cl2+H2O?HCl+HClO,说明HClO有漂白作用.
(2)利用针头连接后,分液漏斗与烧瓶内气压相等,有利于液体流下,故答案为:=;有利于球形分液漏斗里浓盐酸顺利流入烧瓶里;
(3)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、水和氯气,反应方程式为MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(4)①次氯酸能使湿润的有色布条褪色,故答案为:HClO;
②假设:氯气或盐酸或HClO使有色布条褪色.
实验验证方法:a.干燥的Cl2不能使干燥的有色布条褪色,说明Cl2本身没有漂白作用;
b.在干燥的有色布条上滴加盐酸,结果没有褪色现象,说明盐酸及水没有漂白作用;
c.在干燥的有色布条上滴加新制氯水,结果有色布条褪色;
推论:在氯水中存在反应:Cl2+H2O?HCl+HClO,说明HClO有漂白作用;
答:假设:氯气或盐酸或HClO使有色布条褪色;
实验验证方法:a.干燥的Cl2不能使干燥的有色布条褪色,说明Cl2本身没有漂白作用;
b.在干燥的有色布条上滴加盐酸,结果没有褪色现象,说明盐酸及水没有漂白作用;
c.在干燥的有色布条上滴加新制氯水,结果有色布条褪色;
推论:在氯水中存在反应:Cl2+H2O?HCl+HClO,说明HClO有漂白作用.
点评:本题考查了氯气的制取、性质及次氯酸的探究性实验的设计,难度较大,设计实验的步骤是:先提出假设,然后验证假设,最后得出结论,易错的题是(1)题中丁的现象,很多同学可能填写溶液变蓝色,忽视了图片中溶液的分层,实际有萃取实验存在.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目




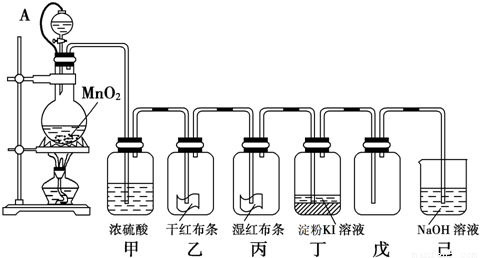
 Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O) 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置
