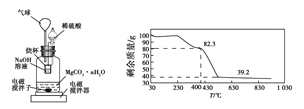
题目内容
【题目】铜、硼、硅、砷等元素的化合物是制造新型激光武器和新型太阳能电池的重要材料。回答下列问题:
(1)基态硅原子电子占据的最高能层符号是_____,其中能量最高的电子所占据能级的原子轨道有_____个伸展方向,原子轨道呈_____形。
(2)在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有____________。
(3)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的第一电离能从大到小的顺序为________(用元素符号表示)。H2SeO3的酸性_______H2SeO4(填“强于”或“弱于”),原因是___________(从分子结构的角度回答)。
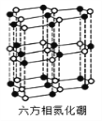
(4)氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。它的晶体结构如下左图所示。六方相氮化硼______π键(填“含有”或“不含”),其质地软的原因是_________。NaBH4是一种重要的储氢载体,阴离子的的立体结构为_______。
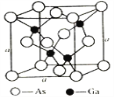
(5)砷化镓是优良的第三代半导体材料。如上图所示为GaAs的晶胞结构。
①与GaAs互为等电子体的一种原子晶体的化学式为________。
②已知晶胞的密度是ρ g·cm3,阿伏加德罗常数值为NA,棱长a=_____pm。
【答案】M 3 哑铃 离子键、配位键 Br>As>Se 弱于 硒的含氧酸中非羟基氧原子数目越多,中心硒原子价态越高,导致Se—O—H中的O的电子更向Se偏移,越易电离出H+ 不含 层间作用力小,导致其质地软 正四面体 SiC ![]()
【解析】
(1)基态硅原子电子占据的最高能层符号是M,其中能量最高的电子所占据能级的原子轨道p轨道,有3个伸展方向,原子轨道呈哑铃形。(2)[Cu(NH3)4]SO4晶体中含有的化学键除普通共价键外,还有离子键、配位键。(3)砷的4p轨道电子处于半充满状态,稳定性强,第一电离能大于相邻元素,则三种元素的第一电离能从大到小的顺序为Br>As>Se;硒的含氧酸中非羟基氧原子数目越多,中心硒原子价态越高,导致Se—O—H中的O的电子更向Se偏移,越易电离出H+,所以H2SeO3的酸性弱于H2SeO4。(4)B位于第2周期ⅢA族,形成的六方相氮化硼,每一个B与3个N原子相连,每1个N原子与3个B原子相连,为平面三角形,向空间发展成层状结构.六方相氮化硼,不含π键,只含σ键,层与层之间通过范德华力结合在一起;作用力小,导致其质地软;BH4中B原子含有的价层电子对数是4,且不存在孤对电子,立体结构为正四面体。(5)①原子数和价电子数分别都相等的是等电子体,则与GaAs互为等电子体的一种原子晶体的化学式为SiC。②晶胞中含有的原子个数均是4个,已知晶胞的密度是ρ g·cm3,阿伏加德罗常数值为NA,则 ,解得a=
,解得a=![]() =
=![]() pm。
pm。