题目内容
12.25℃时,将0.1mo1•L-1氨水与0.1mo1•L-1盐酸按不同比例混合(如表)所得溶液中微粒间关系不正确( )| 编号 | ① | ② | ③ | ④ |
| 氨水体积/mL | 40 | V1 | 30 | 20 |
| 盐酸体积/mL | 20 | 60-V1 | 30 | 40 |
| A. | ①所得溶液中,c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+) | |
| B. | 若②所得溶液pH=7,则c(NH4+)=c(C1-)=1×10-7mo1•L-1 | |
| C. | ③所得溶液中.c(H+)-c(OH-)=c(NH3•H2O) | |
| D. | ④所得溶液中,c(C1-)=2c(NH3•H2O)+2c(NH4+) |
分析 A.混合溶液中溶质为NH4Cl和NH2•H2O,且二者物质的量浓度相等,NH2•H2O电离程度大于NH4+水解程度,导致溶液呈碱性,结合物料守恒判断;
B.若②所得溶液pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=c(C1-),溶液中溶质为NH4Cl和NH2•H2O,其浓度大于c(OH-)、c(H+);
C.③中酸和碱恰好完全反应生成NH4Cl,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
D.④中溶质为HCl、NH4Cl,且二者浓度相等,溶液中存在物料守恒,根据物料守恒判断.
解答 解:A.混合溶液中溶质为NH4Cl和NH2•H2O,且二者物质的量浓度相等,NH2•H2O电离程度大于NH4+水解程度,导致溶液呈碱性,结合物料守恒得c(NH4+)>c(C1-)>c(NH2•H2O)>c(OH-)>c(H+),故A正确;
B.若②所得溶液pH=7,溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(NH4+)=c(C1-),溶液中溶质为NH4Cl和NH2•H2O,其浓度大于c(OH-)、c(H+),所以(NH4+)=c(C1-)>1×10-7mo1•L-1,故B错误;
C.③中酸和碱恰好完全反应生成NH4Cl,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(OH-)+c(C1-)=c(H+)+c(NH4+),根据物料守恒得c(C1-)=c(NH3•H2O)+c(NH4+),所以得c(OH-)+c(NH3•H2O)=c(H+),即c(H+)-c(OH-)=c(NH3•H2O),故C正确;
D.④中溶质为HCl、NH4Cl,且二者浓度相等,溶液中存在物料守恒,根据物料守恒得c(C1-)=2c(NH3•H2O)+2c(NH4+),故D正确;
故选B.
点评 本题以酸碱混合溶液定性判断为载体考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,注意守恒思想的灵活运用,任何电解质溶液中都存在电荷守恒和物料守恒,与电解质强弱及溶液浓度无关,题目难度不大.

| 正极 | 负极 | 电解质溶液 | |
| A | Fe | Cu | FeCl2溶液 |
| B | Cu | Fe | 稀H2SO4 |
| C | Cu | Fe | CuSO4溶液 |
| D | 石墨 | Fe | CuCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
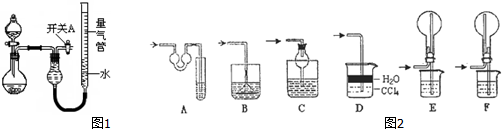
| 实验 | 药品 | 制取气体 | 量气管中的液体 |
| Ⅰ | Cu、稀HNO3 | H2O | |
| Ⅱ | NaOH固体、浓氨水 | NH3 | |
| Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
| Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?不可行(填“可行”或“不可行”).
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是SO2+Br2+2H2O=4H++2Br-+SO42-.
(4)实验Ⅱ中量气管中的液体最好是c(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.图2各种尾气吸收装置中,适合于吸收NH3,而且能防止倒吸的有ACDF.
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,②使量气管两端液面相平,③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积均已换算成标准状况,忽略滴入液体体积对气体体积的影响)
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |
| A. | $\frac{1}{2}$ | B. | $\frac{1}{3}$ | C. | $\frac{1}{4}$ | D. | $\frac{1}{8}$ |
| A. | 实验结果随反应物用量改变而改变 | |
| B. | 实验中氢氧化钠溶液稍过量是为了使盐酸完全被氢氧化钠中和 | |
| C. | 实验中不可用环形铜质搅拌棒代替环形玻璃搅拌棒 |
 .该方程式的氧化剂为H2SO4;被氧化的元素为Cu.
.该方程式的氧化剂为H2SO4;被氧化的元素为Cu.