��Ŀ����
����Ŀ���״���CH3OH������Ҫ���ܼ������ȼ����CO��H2�Ļ�������׳ƺϳ�����������һ���������Ʊ�CH3OH��
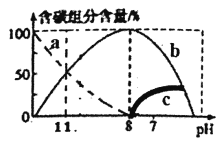
��1�������ܱ������г���CO��H2���о�������������ʱ�¶ȶԺϳɼ״���ӦӰ�죺CO(g)+2H2(g) ![]() CH3OH(g)��ʵ������ͼ��ʾ��
CH3OH(g)��ʵ������ͼ��ʾ��

���¶ȸߵͱȽϣ�T1____T2��
�������ж���ȷ����______________��
A.�÷�Ӧ�Ƿ��ȷ�Ӧ
B.�÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ��С
C.�� T1��T2����S��С
D.����A��ķ�Ӧ��ϵ��T1�䵽T2���ﵽƽ��ʱ![]() ����
����
����T1�¶�ʱ����1.00molCO��2.00molH2����1.00L�����ܱ������У���ַ�Ӧ�ﵽƽ����������������ѹǿ��С����ʼʱ��һ�룬��ʱCO��ת����Ϊ______________��ƽ�ⳣ��Ϊ________________�������������
��2����һ�����ݵ��ܱ������з�����ӦCO(g)+2H2(g) ![]() CH3OH(g)���ڲ�ͬʱ��ⶨ�ĸ��ɷ����ʵ���Ũ�����±���
CH3OH(g)���ڲ�ͬʱ��ⶨ�ĸ��ɷ����ʵ���Ũ�����±���
ʱ�� | Ũ��(mol/L) | ||
c(CO) | c(H2) | c(CH3OH) | |
��0 min | 4.0 | 8.0 | 0 |
��10min | 3.8 | 7.6 | 0.2 |
��20min | 3.4 | 6.8 | 0.6 |
��30min | 3.4 | 6.8 | 0.6 |
��40min | 3.9 | 7.8 | 0.1 |
�� CO��ƽ����Ӧ����v(0min��10min)/ v(10min��20min)��________________��
�� ���ڵ�30minʱ�ı��˷�Ӧ�������ı�ķ�Ӧ����������______________��
���𰸡� �� AD 75% 12L2/mol2 1��2 �����¶�
��������(1)�ٸ������ȹ���ƽ��ֵ����֪T1��T2���ʴ�Ϊ������
��A.�������ȹ���ƽ��ֵ����֪T1��T2�������¶ȣ��״������ʵ�����С����ƽ�����淴Ӧ�����ƶ�������淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ����A��ȷ��B���������ȹ���ƽ��ֵ����֪T1��T2�������¶ȣ��״������ʵ�����С����ƽ�����淴Ӧ�����ƶ�������ƽ�ⳣ����K(T1)��K (T2)����B����C.�� T1��T2�����������¶ȣ�ƽ�������ƶ�����������ʵ���������S����C����D�������¶�ƽ�������ƶ����ﵽƽ��ʱ![]() ����D��ȷ����ѡAD��
����D��ȷ����ѡAD��
���跴Ӧ��CO�����ʵ���Ϊx��
CO(g)+2H2(g)CH3OH(g)
����(mol)��1 2 0
�仯(mol)��x 2x x
ƽ��(mol)��1-x 2-2x x
�����ѹǿ��С����ʼʱ��һ�룬˵����������ʵ������ԭ����һ�룬��(1-x)+(2-2x)+x=1.5�����x=0.75mol��CO��ת����=![]() ��100%=75%���������Ϊ1L�����ƽ�ⳣ��K=
��100%=75%���������Ϊ1L�����ƽ�ⳣ��K=![]() =12���ʴ�Ϊ��75%��12��
=12���ʴ�Ϊ��75%��12��
(2)��CO��ƽ����Ӧ����![]() =
=![]() =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ�� ![]() ��
��
���ɱ������ݿ�֪����20minŨ�Ȳ��ٱ仯����Ӧ�ﵽ��ƽ��״̬����30minʱ�ı���������ƽ�������ƶ���c(CO)��c(H2)��c(CH3OH)�ı仯���ֱ�Ϊ0.5 mol/L��1.0 mol/L��0.5 mol/L�����㷽��ʽ���ʲ�����Ϊ����ijһ����Ũ�ȣ�����ѹǿ��Ӧ������Ũ�ȶ�Ӧ����˵���ı�������������Ǵ�����Ҳ��������Ũ�Ⱥ�ѹǿ��ֻ���Ǹı���¶ȣ�����30min��40min֮�䷴Ӧ���ʱ�10min��20min�죬ֻ���������¶ȣ��ʴ�Ϊ�������¶ȡ�