题目内容
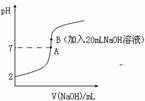
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF![]() H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 已知:电离度(
已知:电离度(![]() )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ ,
电离度![]() 为_ _%。
为_ _%。
(3)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)已知该温度下Ksp(CaF2)=1.5×10-10。取B点时的溶液10mL与90mL1×10-4 mol·L-1 CaCl2溶液混合,通过列式计算说明是否有沉淀产生。
(1) a d(2分); a(2分)
(2) 5×10-4(2分); 5(2分)
(3) b d(2分)
(4)混合后c(F-)=10-2mol/L,c(Ca2+)=9×10-5mol/L
Q=9×10-9>Ksp有沉淀产生。

练习册系列答案
相关题目
 H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。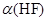 约为___ _%。
约为___ _%。 = Ka(HF)
= Ka(HF) H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。 约为___
_%。
约为___
_%。 = Ka(HF)
= Ka(HF)