题目内容
12.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 在常温常压下,11.2L Cl2含有的分子数为0.5NA | |
| B. | 1 L 0.5 mol•L-1硝酸钡溶液中所含NO3-数为0.5 NA | |
| C. | 2.4g Mg与足量的氮气完全反应失去的电子数为0.2NA | |
| D. | 在标准状况下,11.2L H2O含有的分子数为0.5NA |
分析 A、常温常压下,气体摩尔体积大于22.4L/mol;
B、求出硝酸钡的物质的量n=CV,然后根据1mol硝酸钡中含2molNO3-来计算;
C、求出镁的物质的量,然后根据反应后镁变为+2价来分析;
D、标况下,水为液态.
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2L氯气的物质的量小于0.5mol,则分子数小于0.5NA个,故A错误;
B、溶液中硝酸钡的物质的量n=CV=0.5mol/L×1L=0.5mol,而1mol硝酸钡中含2molNO3-,故0.5mol硝酸钡中含1molNO3-即NA个,故B错误;
C、2.4g镁的物质的量为0.1mol,而反应后镁变为+2价,故0.1mol镁失去0.2mol电子即0.2NA个,故C正确;
D、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2.在25℃时.将两个铂电极插入一定量的饱和Na2SO4溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时析出的固体中含有w克Na2SO4•10H2O晶体,若温度不变,此时剩余溶液的质量分数是( )
| A. | $\frac{71}{161}$×100% | B. | $\frac{w}{w+36a}$×100% | ||
| C. | $\frac{7100w}{161(w+18a)}$% | D. | $\frac{71w}{161(w+36a)}$×100% |
20.下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A. | Fe(OH)3胶体、白磷、石灰乳 | B. | 干冰、铁、氯化氢 | ||
| C. | 烧碱、液态氧、碘酒 | D. | 空气、氮气、明矾 |
7.如图所示,下列叙述正确的是( )
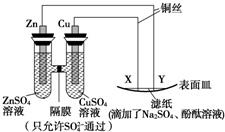

| A. | Y为负极,发生氧化反应 | B. | X为阴极,发生还原反应 | ||
| C. | Y与滤纸接触处变红 | D. | X与滤纸接触处有H2生成 |
17.用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图象如下:
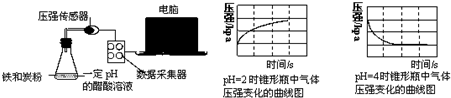
分析图象,以下结论错误的是( )

分析图象,以下结论错误的是( )
| A. | 析氢腐蚀和吸氧腐蚀的速率一样快 | |
| B. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| C. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
4.下列说法中,正确的是( )
| A. | 分解反应一定是氧化还原反应 | |
| B. | 非金属单质在化学反应中一定是氧化剂 | |
| C. | 金属单质在化学反应中一定是还原剂 | |
| D. | 元素由化合态转化为游离态,该元素一定被还原 |
1.酸雨的形成主要是由于( )
| A. | 森林遇到乱砍乱伐,破坏了生态平衡 | |
| B. | 燃放烟花爆竹 | |
| C. | 大气中二氧化碳的含量增加 | |
| D. | 工业上大量燃烧含硫燃料 |
2.过氧化钠与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的是( )
| A. | Na2CO3和Na2O2 | B. | 只有Na2CO3 | C. | Na2CO3和NaOH | D. | Na2O和NaHCO3 |