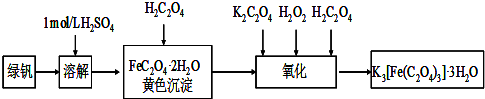
题目内容
三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)是一种光敏材料,在110℃可完全失去结晶水。为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤一:称量5.40g三草酸合铁酸钾晶体,配制成250ml溶液。
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入适量锌粉使Fe3+全部转化为Fe2+,同时有气泡产生,过滤,洗涤,将过滤及洗涤所得溶液A收集到锥形瓶中,此时,溶液仍呈酸性。
步骤三:用0.010mol/L KMnO4溶液滴定溶液A至终点,消耗KMnO4溶液21.98ml,反应中MnO4-被还原成Mn2+ 。
重复步骤二、步骤三操作,消耗0.010mol/L KMnO4溶液22.02ml。
请回答下列问题:
①配制三草酸合铁酸钾溶液的操作依次是:称量、溶解、冷却、转移、洗涤、 、摇匀。
②“步骤一”所得溶液的颜色为 。
③写出“步骤二”中加锌粉产生气泡的离子方程式 ;
写出“步骤二”中Fe3+转化为Fe2+的离子方程式 。
④“步骤三”KMnO4溶液应装在 式滴定管中;检查该滴定管不漏水,用水洗净后,装入KMnO4标准溶液前,要对该滴定管进行的操作是 ;
判断滴定至终点依据的现象是 。
⑤实验测得该晶体中铁的质量分数为 。
(共16分,每空2分)
①定容(有“定容”计2分,多答不扣分) ②黄色
③Zn + 2H+=Zn2+ + H2↑ Zn + 2Fe3+ =2 Fe2+ + Zn2+
④酸 润洗(答到润洗即可,详细表述也行) 锥形瓶内溶液变红色且半分钟内不消失
⑤11.4%
解析试题分析:①在配制物质的量浓度的溶液时,要经过:计算→称量→溶解→移液、洗涤→振荡→定容→摇匀等步骤定容;
②加入锌粉的目的是将Fe3+恰好还原成Fe2+,故答案为:黄色;
③在步骤三中发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
⑤KMnO4具有强氧化性,应装在酸式滴定管中。滴定管使用前进行的操作是润洗。判断滴定至终点依据的现象是锥形瓶内溶液变红色且半分钟内不消失。
④根据步骤三中的离子反应可知:n(Fe)=5n(MnO4-)=5×[(21.98mL+22.02mL)/2]×0.01 mol?L-1×10-3×10=.1.1×10-2mol,m(Fe)="56" g?mol-1×1.01×10-2mol=0.57g.晶体中铁的质量分数=0.57g/5g×100%=11.4%。
考点:探究物质的组成或测量物质的含量 氧化还原反应 溶液的配制
点评:本题考查较为综合,涉及到溶液的配制、滴定和结晶等操作,注意基础实验知识的积累,把握实验步骤、原理和注意事项等问题。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案