题目内容
【题目】在溶液中Cl2可氧化二氧化硫:Cl2+SO2+2H2O→2HCl+H2SO4,下图是有关二氧化硫性质的实验装置图,试回答下列问题:
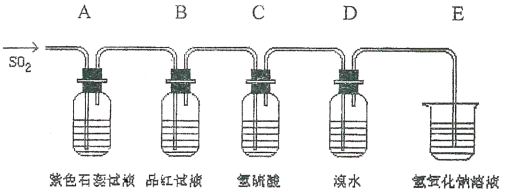
(1)A、B、C、D四个装置中发生的现象依次是_________、________、_________、_________。
(2)二氧化硫具有:(1)漂白性 (2)酸性氧化物的性质 (3)还原性 (4)氧化性。在上图几个装置中对应表现出的性质是(填序号)A中_____B中____C中______D中______。
(3)实验完毕后,取少量D中溶液于试管中,加入BaCl2溶液和稀盐酸,现象是_______________。
(4)E中发生反应的化学方程式为_____________________________。
【答案】变红 褪色 浅黄色沉淀 褪色 (2) (1) (4) (3) 产生白色沉淀 SO2+2NaOH=Na2SO3+H2O
【解析】
(1)SO2+H2O![]() H2SO3,石蕊遇酸变红,SO2有漂白性,品红褪色,2H2S+SO2=3S↓+2
H2SO3,石蕊遇酸变红,SO2有漂白性,品红褪色,2H2S+SO2=3S↓+2
H2O,黄色浑浊,Br2+2H2O+SO2=2HBr+H2SO4,溴水褪色;故答案为:变红;褪色;浅黄色沉淀;褪色;
(2)A中表现SO2酸性氧化物的性质;B中表现SO2漂白性;C中表现SO2氧化性;D中表现SO2的还原性;故答案为:(2);(1);(4);(3);
(3)Br2+2H2O+SO2=2HBr+H2SO4,溶液中含有SO42-,与Ba2+结合成白色沉淀BaSO4;故答案为:产生白色沉淀;
(4)足量的氢氧化钠与SO2反应生成亚硫酸盐和水,故答案为:2NaOH+SO2=Na2SO3+H2O。

练习册系列答案
相关题目
