题目内容
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。
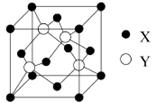
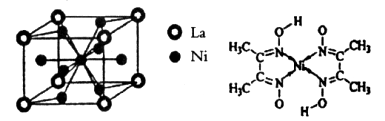
(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。

(1)X与Y所形成化合物晶体的晶胞如右图所示。
①在1个晶胞中,X离子的数目为 。
②该化合物的化学式为 。
(2)在Y的氢化物分子中,Y原子轨道的杂化类型是 。
(3)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是 。
(4)Y 与Z 可形成YZ42-
①YZ42-的空间构型为 。
②写出一种与YZ42-互为等电子体的分子的化学式: 。
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
.(10分)(1)①4 (1分) ②ZnS(1分) (2)sp3(2分)
(3)水分子与乙醇分子之间形成氢键(2分)
(4)①正四面体(1分) ②CCl4或SiCl4等(1分)
(5)16NA或16×6. 02×1023个(2分)
(3)水分子与乙醇分子之间形成氢键(2分)
(4)①正四面体(1分) ②CCl4或SiCl4等(1分)
(5)16NA或16×6. 02×1023个(2分)
试题分析:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为2,所以该原子有30个电子,为Zn元素;元素Y基态原子的3p轨道上有4个电子,则Y是S元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素。
(1)①根据晶胞的结构并依据均摊法可知,X离子数目=
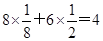 。
。②该晶胞中Y离子数目=4,所以X和Y离子数目之比等于4:4即1:1,所以该化合物的化学式为ZnS。
(2)在H2S中硫原子的价层电子数=2+(6-2×1)÷2=4,所以采用sp3杂化。
(3)在乙醇的水溶液中,水分子和乙醇分子之间易形成氢键,氢键的存在导致其溶解性增大。
(4)①SO42-中价层电子数=4+(6+2-4×2)÷2=4,由于没有孤电子对,所以是正四面体结构。
②原子数和价电子数均相等的是等电子体,所以与YZ42-互为等电子体的分子的化学式为CCl4或SiCl4 等。
(5)单键都是σ键,所以1mol配合物[X(NH3)4]Cl2中,σ键数目=(3×4+4)NA=16NA。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养。本题考查的知识点比较多,涉及化学式的确定、氢键、杂化方式的判断等知识点,明确化学式的确定方法、氢键对物质性质的影响、杂化方式的判断方法等是解本题关键,注意配合物[Zn(NH3)4]Cl2中,配位键也是σ键,为易错点。

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
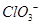 的空间构型为平面三角形
的空间构型为平面三角形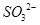 的中心原子均为sp3杂化
的中心原子均为sp3杂化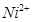 和
和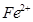 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);