题目内容
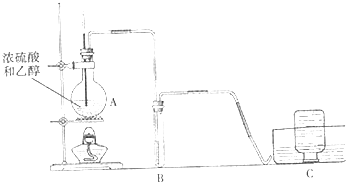
实验室用下图所示装置制取溴化亚铁.其中A为CO2发生装置,D和d中均盛有液溴,E为外套电炉丝的不锈钢管.e是两只耐高温的瓷皿,其中共盛有56g细铁粉.实验开始时先将铁粉加热至600℃~700℃,然后将干燥、纯净的CO2气流通入D中,E管中反应开始,最后将d中液溴滴入100℃~120℃的D中,经过几小时的连续反应,在铁管的一端沉积有黄绿色鳞片状溴化亚铁80g.
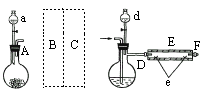
请回答:
(1)如何检查用塞子(插有导管和仪器)塞紧的D的气密性________.
(2)若导入的CO2不干燥,会在E中发生副反应,其化学方程式为________;若在A中盛固体CaCO3,a中盛6mol/L盐酸,为使导入D中的CO2为干燥纯净的气体,则图中B、C处的装置和其中的试剂应是:B为________,C为________.
(3)实验时,装置D和E的橡皮塞最好用铅箔包住,原因是________.
(4)反应过程中要不断通入CO2,其主要作用是①________,②________.
(5)E中的反应为:2Fe+3Br2![]() 2FeBr3,2FeBr3
2FeBr3,2FeBr3![]() 2FeBr2+Br2↑,求此实验中FeBr2的产率________.
2FeBr2+Br2↑,求此实验中FeBr2的产率________.
(6)为防止污染空气,实验时应在F处连接盛________的尾气吸收装置.
答案:
解析:
解析:
|
(1)关闭d的活塞,夹紧C~D之间的胶管,将下出口导管插入水中,然后将D用手捂热,若下导管出口有气泡冒出,松开手后水回升到导管中,则证明D装置不漏气. (2)3Fe+4H2O (3)Br2蒸气会腐蚀胶塞 (4)①用CO2把反应器中空气赶尽;②将Br2蒸气带入反应管中 (5)37.04% (6)NaOH溶液 |

练习册系列答案
相关题目
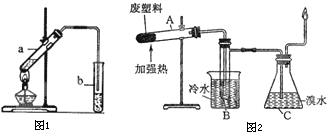
(1)某同学为探究蔗糖的水解反应,进行如下实验,填写实验步骤III的实验现象:
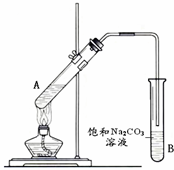
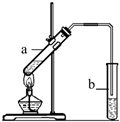
(2)“酒是陈的香”的原因之一是储存过程中生成了有香味的酯.实验室用下图所示装置制取乙酸乙酯.
①试管a中生成乙酸乙酯的化学反应方程式是 .
②试管b中盛放的试剂是 溶液
③若要把b中制得的乙酸乙酯从混合物中分离出来,应采用的实验操作是 .
④生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) .
a单位时间里,生成1mol乙酸乙酯,同时生成1mol水
b单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
c单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
d正反应的速率与逆反应的速率相等
e混合物中各物质的浓度不再变化
(3)加热聚丙烯塑料得到的产物如表:
实验装置如图所示.
①试管A中的最终残余物为 ;
②试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有 种.
③锥形瓶C中观察到的现象是 ;经溴水充分吸收再干燥后,剩余两种气体的平均相对分子质量为 .

| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
①试管a中生成乙酸乙酯的化学反应方程式是
②试管b中盛放的试剂是
③若要把b中制得的乙酸乙酯从混合物中分离出来,应采用的实验操作是
④生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
a单位时间里,生成1mol乙酸乙酯,同时生成1mol水
b单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
c单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
d正反应的速率与逆反应的速率相等
e混合物中各物质的浓度不再变化
(3)加热聚丙烯塑料得到的产物如表:
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
①试管A中的最终残余物为
②试管B收集到的产品中,有能使酸性高锰酸钾溶液褪色的物质,该物质的一氯代物有
③锥形瓶C中观察到的现象是
 煤、石油、天然气是重要的化石燃料,也是重要的化工原料.
煤、石油、天然气是重要的化石燃料,也是重要的化工原料.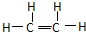
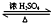 CH3COOC2H5+H2O
CH3COOC2H5+H2O