题目内容
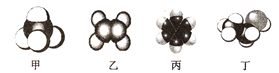
【题目】四种常见有机物分子的比例模型示意图如下,其中甲、乙、丙为烃,丁为烃的衍生物。
(1)可以鉴别甲和乙的试剂为__________;
a.稀硫酸 b.溴的四氯化碳溶液 c.水 d.酸性高锰酸钾溶液
(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是______(填名称),将其加入溴水中,振荡后静置,观察到的现象是______。
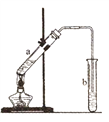
(3)以乙为主要原料合成乙酸,合成路线如图所示:(已知2CH3CHO+O2![]() 2CH3COOH)
2CH3COOH)
![]()
①丁生成A的化学方程式为_______________;
②如图,丁与乙酸在浓硫酸作用下发生反应,当观察到b试管中有明显现象时,停止实验。生成的有机物的结构简式为___________;试管b中的溶液是___________。
【答案】 bd 苯 液体分为两层,上层为橙红色,下层为无色 2CH3CH2OH+O2![]() 2CH3CHO+2H2O CH3COOHCH2CH3 饱和Na2CO3溶液
2CH3CHO+2H2O CH3COOHCH2CH3 饱和Na2CO3溶液
【解析】根据有机物分子的比例模型可知甲、乙、丙、丁分别是甲烷、乙烯、苯和乙醇。
(1)a.稀硫酸与甲烷和乙烯均不反应,不能鉴别,a错误;b.乙烯能使溴的四氯化碳溶液褪色,可以鉴别,b正确;c.甲烷和乙烯均不溶于水,不能鉴别,c错误;d.乙烯能酸性高锰酸钾溶液褪色,可以鉴别,d正确,答案选bd;(2)上述物质中有毒、有特殊气味,且不溶于水、密度比水小的是苯,将其加入溴水中发生萃取,振荡后静置,观察到的现象是液体分为两层,上层为橙红色,下层为无色。(3)乙烯与水发生加成反应生成乙醇,乙醇发生催化氧化生成乙醛,乙醛氧化生成乙酸。则①丁生成A的化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;②乙酸与乙酸在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,乙酸乙酯的有机物的结构简式为CH3COOHCH2CH3;生成的乙酸乙酯中含有乙酸和乙醇,可以用饱和碳酸钠溶液吸收,即试管b中的溶液是饱和Na2CO3溶液。
2CH3CHO+2H2O;②乙酸与乙酸在浓硫酸作用下发生酯化反应,生成乙酸乙酯和水,乙酸乙酯的有机物的结构简式为CH3COOHCH2CH3;生成的乙酸乙酯中含有乙酸和乙醇,可以用饱和碳酸钠溶液吸收,即试管b中的溶液是饱和Na2CO3溶液。

【题目】下表中根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X一定是浓盐酸 |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2的强 |
C | 强酸性溶液Y中加入Ba(NO3)2溶液,静置后再加入KSCN溶液 | 先有白色沉淀,后溶液又变红 | Y中一定含有SO |
D | C2H5OH与浓硫酸混合后加热到170 ℃ | 制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
A. A B. B C. C D. D
【题目】Ⅰ.下表为元素周期表的一部分,请按要求回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | ④ | ⑤ | |||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中元素______的非金属性最强,元素_____的金属性最强(填元素符号)。
(2)表中元素④、⑨形成的氢化物的稳定性顺序为_____>______(填化学式)。
(3)表中元素③、④、⑥、⑦的原子半径大小为____>____>___>___(填元素符号)。
Ⅱ.A、B、W、D、E为短周期元素,且原子序数依次增大,五种元素核内质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)A2W的电子式为________。(2) E元素在周期表中的位置为_______ 。
(3)W、D、E三种元素的简单离子半径由小到大的顺序为_______(填离子符号)。
(4)在一定条件下,D元素的单质能与A元素的单质化合生成DA,DA能与水反应放氢气,则其化学方程式为_______
(5)若要比较D和E的金属性强弱,下列实验方法可行的是_______。
a.将D单质置于E的盐溶液中,若单质D不能置换出单质E,说明D的金属性弱
b.将少量D、E的单质分别投入到水中,若D反应而E不反应,说明D的金属性强
C.比较相同条件下D和E的最高价氧化物对应水化物的溶解性若前者比后者溶解度大,说明D的金属性强


