题目内容
(1)若某可逆反应的化学平衡常数表达式为:K=
| c(CO)?c(H2) | c(H2O) |
①写出该反应的化学方程式:
②能判断该反应一定达到化学平衡状态的依据是
A.容器中气体的平均相对分子质量不随时间而变化
B.υ正(H2O)=υ逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总质量不随时间而变化
E.消耗n mol H2的同时消耗n mol CO
(2)已知N2(g)+3H2(g)?2NH3(g)△H=-92.3kJ?mol?1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态Ⅰ;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,达到平衡状态Ⅱ,则:(①-④小题填大于、等于、小于)

①两个平衡状态的平衡常数的关系:Ⅰ
②H2的百分含量Ⅰ
③N2的转化率:Ⅰ
④反应放出的热量:Ⅰ
⑤该反应的逆反应速率随时间变化的关系如图.t1时改变了某种条件,改变的条件可能是
②化学平衡的根本原因是正、逆反应速率相等,反应混合物中各组分的百分含量保持不变,然后根据具体的化学方程式,逐一判断.
(2)已知N2(g)+3H2(g)?2NH3(g)△H=-92.3kJ?mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态Ⅰ,相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡状态Ⅱ和平衡状态Ⅰ相同,属于等效平衡,
①温度不变平衡常数不变;
②达到平衡时平衡状态Ⅱ和平衡状态Ⅰ相同,属于等效平衡,所以H2的百分含量相同;
③由于平衡Ⅱ开始时加入了0.2molNH3,所以N2的转化生成的氨气的量比平衡Ⅰ少,;
④由于平衡Ⅱ开始时加入了0.2molNH3,所以N2的转化生成的氨气的量比平衡Ⅰ少,反应放出的热量反应放出的热量比平衡Ⅰ少;
⑤t1时改变了某种条件,正逆速率都增大,平衡正移,所以改变条件为加压;
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
②A、反应前后气体的体积不相同,容器中气体的平均相对分子质量不断减小,当不随时间变化即达到平衡,故A正确;
B、υ正(H2O)=υ逆(H2)时,反应达到平衡,故B正确;
C、反应开始时,容器中气体的密度不断减小,当不随时间变化时,反应达到平衡,故C正确;
D、容器中总质量自始至终不随时间而变化,故D错误;
E、消耗n mol H2的同时消耗n mol CO,反应都代表逆反应,故E错误;
故答案为:A、B、C;
(2)已知N2(g)+3H2(g)?2NH3(g)△H=-92.3kJ?mol-1,在一定温度和催化剂的条件下,向一密闭容器中,通入1molN2和3molH2,达到平衡状态Ⅰ;相同条件下,向另一体积相同的密闭容器中通入0.9molN2、2.7molH2和0.2molNH3,转化起始量为1molN2和3molH2,达到平衡时平衡状态Ⅱ和平衡状态Ⅰ相同,属于等效平衡;
①温度不变平衡常数不变,所以两个平衡状态的平衡常数的关系:Ⅰ等于Ⅱ,
故答案为:等于;
②达到平衡时平衡状态Ⅱ和平衡状态Ⅰ相同,属于等效平衡,所以H2的百分含量Ⅰ等于Ⅱ,
故答案为:等于;
③由于平衡Ⅱ开始时加入了0.2molNH3,所以N2的转化生成的氨气的量比平衡Ⅰ少,则转化率:Ⅰ大于Ⅱ,
故答案为:大于;
④由于平衡Ⅱ开始时加入了0.2molNH3,所以N2的转化生成的氨气的量比平衡Ⅰ少,反应放出的热量反应放出的热量比平衡I少,所以:Ⅰ大于Ⅱ,
故答案为:大于;(二者均放热)
⑤该反应的逆反应速率随时间变化的关系如图.t1时改变了某种条件,正逆速率都增大,平衡正移,所以改变条件为加压,
故答案为:加压.

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为: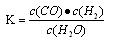
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 | B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 | D.容器中总的物质的量不随时间而变化 |
(Ⅱ)某高温下,若该5 L密闭容器中加入的是2molFe(s)与1.00mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.50mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)计算该可逆反应t2达到平衡时的K值。(要求写出计算过程)
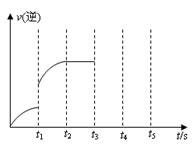
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)
(16分)一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为: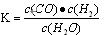
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总质量不随时间而变化 |
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为
0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。
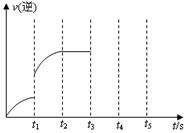
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向
正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)
(11分)
(Ⅰ)有可逆反应A(g) + 3B(g)  2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示: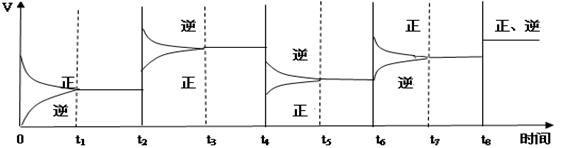
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为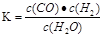
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |

