题目内容
(16分)一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总质量不随时间而变化 |
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol H2O(g),t1秒时,H2的物质的量为
0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol 。

(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)若继续加入2 mol Fe(s),则平衡 移动(填“向
正反应方向”、“向逆反应方向”或“不”),继续通入1mol H2O(g) 再次达到平衡后,H2物质的量为 mol。
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 (填写2项)
(16分)
(Ⅰ)(1)C(s)+H2O(g) 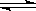 CO(g)+H2 (g) (3分) (2)A、B、C(3分)
CO(g)+H2 (g) (3分) (2)A、B、C(3分)
(Ⅱ)(1)0.03/(t2-t1) mol·L-1·s-1(2分)
(2)不(2分); 0.7 (2分)
(3)使用了催化剂、升高了温度、增大了H2的浓度(任答2条,各2分)
解析

一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 | B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 | D.容器中总的物质的量不随时间而变化 |
(Ⅱ)某高温下,若该5 L密闭容器中加入的是2molFe(s)与1.00mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.50mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)计算该可逆反应t2达到平衡时的K值。(要求写出计算过程)
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)

(11分)
(Ⅰ)有可逆反应A(g) + 3B(g)  2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3 ;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示:
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时______ _____;t6时___ _______;t8时_______ ____。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |

