��Ŀ����
��ͬѧ����ϸ���������װ��ͼ���ش��������⣺
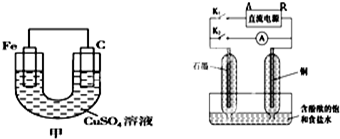
��1���׳���̼���ĵ缫��Ӧʽ�� ��
��2������׳���CuSO4��Һ�����������缫��������ʼʱ��ȣ�һ��ʱ������缫��������Ϊ12g����������·��ת�Ƶĵ�����ĿΪ ��
��3���ҳ�ʵ��ʱ���ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����Aָ��ƫת��
�ٶϿ�K2���պ�K1ʱ��ֱ����Դ��Ϊ�������A����B��������ʱ�����ܷ�Ӧ�����ӷ���ʽΪ�� ����һ��ʱ������缫���ռ�����״����1120mL���壬���ʱ��Һ��PHΪ �����賣���´�ʱ��Һ�����Ϊ500mL����
�ڶϿ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦʽΪ�� ��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴����Ӧһ��ʱ�������Һ�п��ܳ��ֵ������� ��

��1���׳���̼���ĵ缫��Ӧʽ��
��2������׳���CuSO4��Һ�����������缫��������ʼʱ��ȣ�һ��ʱ������缫��������Ϊ12g����������·��ת�Ƶĵ�����ĿΪ
��3���ҳ�ʵ��ʱ���ȶϿ�K2���պ�K1�������������ݲ�����һ��ʱ��Ͽ�K1���պ�K2�����ֵ�����Aָ��ƫת��
�ٶϿ�K2���պ�K1ʱ��ֱ����Դ��Ϊ�������A����B��������ʱ�����ܷ�Ӧ�����ӷ���ʽΪ��
�ڶϿ�K1���պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦʽΪ��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴����Ӧһ��ʱ�������Һ�п��ܳ��ֵ�������
���㣺ԭ��غ͵��صĹ���ԭ��
ר�⣺�绯ѧר��
��������1����װ����ԭ��أ�Fe��ʧ������������CΪ������������ͭ���ӷŵ磻
��2�������Ϸ�ӦFe-2e-=Fe2+��������ӦΪCu2++2e-=Cu�������������١������������ӣ��������缫����������ܽ���������ͭ������֮�ͣ����ݽ�����ת�Ƶ���֮��Ĺ�ϵ���㣻
��3���ٶϿ�K2���պ�K1ʱ�������������ݲ�����˵��ͭ��������ʯī����������A�������������������ӷŵ硢�����������ӷŵ磻
��һ��ʱ������缫���ռ�����״����1120mL���壬�����ʵ���=
=0.05mol������ת�Ƶ������֪�������缫�������������ʵ�����ȣ������������������ʵ���Ϊ0.025mol�������������������������Ĺ�ϵ������Һ��pH��
�ڶϿ�K1���պ�K2ʱ���γ�ԭ��أ�ͭ�缫������ʧ���ӷ���������Ӧ��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴��Cu�缫��ͭʧ���ӷ���������Ӧ��ʯī�缫�������ӷŵ�����������ͬʱ��Һ�����������������ɣ�ͭ�����ڼ�������������������ͭ������
��2�������Ϸ�ӦFe-2e-=Fe2+��������ӦΪCu2++2e-=Cu�������������١������������ӣ��������缫����������ܽ���������ͭ������֮�ͣ����ݽ�����ת�Ƶ���֮��Ĺ�ϵ���㣻
��3���ٶϿ�K2���պ�K1ʱ�������������ݲ�����˵��ͭ��������ʯī����������A�������������������ӷŵ硢�����������ӷŵ磻
��һ��ʱ������缫���ռ�����״����1120mL���壬�����ʵ���=
| 1.12L |
| 22.4L/mol |
�ڶϿ�K1���պ�K2ʱ���γ�ԭ��أ�ͭ�缫������ʧ���ӷ���������Ӧ��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴��Cu�缫��ͭʧ���ӷ���������Ӧ��ʯī�缫�������ӷŵ�����������ͬʱ��Һ�����������������ɣ�ͭ�����ڼ�������������������ͭ������
���
�⣺��1����װ����ԭ��أ�Fe��ʧ������������CΪ������������ͭ���ӷŵ磬�缫��ӦʽΪCu2++2e-=Cu���ʴ�Ϊ��Cu2++2e-=Cu��
��2�������Ϸ�ӦFe-2e-=Fe2+��������ӦΪCu2++2e-=Cu�������������١������������ӣ��������缫����������ܽ���������ͭ������֮�ͣ�����ת�Ƶ������֪���ܽ�Fe������Cu�����ʵ�����ȣ���Fe��Cu�����ʵ����ֱ�Ϊxmol����56+64��g/mol��xmol=12g��x=0.1mol����������ת�Ƶ��ӹ�ϵ֪��ת�Ƶ��ӵ����ʵ�����ĿΪ0.2NA���ʴ�Ϊ��0.2NA��
��3���ٶϿ�K2���պ�K1ʱ�������������ݲ�����˵��ͭ��������ʯī����������A�������������������ӷŵ硢�����������ӷŵ磬��ط�ӦʽΪ2Cl-+2H2O
Cl2��+H2��+2OH-��
��һ��ʱ������缫���ռ�����״����1120mL���壬�����ʵ���=
=0.05mol������ת�Ƶ������֪�������缫�������������ʵ�����ȣ������������������ʵ���Ϊ0.025mol������2Cl-+2H2O
Cl2��+H2��+2OH-֪������n��NaOH��=0.05mol��C��OH-��=
=0.1mol/L������Һ��pH=13��
�ʴ�Ϊ��2Cl-+2H2O
Cl2��+H2��+2 OH-��13��
�ڶϿ�K1���պ�K2ʱ���γ�ԭ��أ�ͭ�缫������ʧ���ӷ���������Ӧ���缫��ӦʽΪ2H2-2e-=2H+���ʴ�Ϊ��2H2-2e-=2H+��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴��Cu�缫��ͭʧ���ӷ���������Ӧ��ʯī�缫�������ӷŵ�����H2��ͬʱ��Һ����OH-���ɣ�Cu2++2OH-=Cu��OH��2�������Կ���������������ɫ�������ɣ��ʴ�Ϊ������ɫ�������ɣ�
��2�������Ϸ�ӦFe-2e-=Fe2+��������ӦΪCu2++2e-=Cu�������������١������������ӣ��������缫����������ܽ���������ͭ������֮�ͣ�����ת�Ƶ������֪���ܽ�Fe������Cu�����ʵ�����ȣ���Fe��Cu�����ʵ����ֱ�Ϊxmol����56+64��g/mol��xmol=12g��x=0.1mol����������ת�Ƶ��ӹ�ϵ֪��ת�Ƶ��ӵ����ʵ�����ĿΪ0.2NA���ʴ�Ϊ��0.2NA��
��3���ٶϿ�K2���պ�K1ʱ�������������ݲ�����˵��ͭ��������ʯī����������A�������������������ӷŵ硢�����������ӷŵ磬��ط�ӦʽΪ2Cl-+2H2O
| ||
��һ��ʱ������缫���ռ�����״����1120mL���壬�����ʵ���=
| 1.12L |
| 22.4L/mol |
| ||
| 0.05mol |
| 0.5L |
�ʴ�Ϊ��2Cl-+2H2O
| ||
�ڶϿ�K1���պ�K2ʱ���γ�ԭ��أ�ͭ�缫������ʧ���ӷ���������Ӧ���缫��ӦʽΪ2H2-2e-=2H+���ʴ�Ϊ��2H2-2e-=2H+��
�����ҳصĵ�Դ��������ʼʱ����������Դ���෴��Cu�缫��ͭʧ���ӷ���������Ӧ��ʯī�缫�������ӷŵ�����H2��ͬʱ��Һ����OH-���ɣ�Cu2++2OH-=Cu��OH��2�������Կ���������������ɫ�������ɣ��ʴ�Ϊ������ɫ�������ɣ�
���������⿼����ԭ��غ͵���ԭ������ȷ�����缫�Ϸ����ķ�Ӧ�ǽⱾ��ؼ���ע�⣺���ý���������ʱ�������Ͻ���ʧ���ӷ���������Ӧ��Ϊ�״��㣮

��ϰ��ϵ�д�
�����Ŀ
��100mL 18mol/L��ŨH2SO4��Һ�м�����������Ƭ���ȣ���ַ�Ӧ�����������ڱ�״���µ����Ϊ����ʾ��2Fe+6H2SO4��Ũ��
Fe2��SO4��3+SO2��+6H2O����������
| ||
| A����20.16L |
| B������20.16L |
| C������20.16L��40.32L֮�� |
| D������40.32L |
��NA���������ӵ�������ֵ������˵����ȷ���ǣ�������
| A����2mol NO��1mol O2��Ϻ���ϵ�е�ԭ����������6NA |
| B��0.01mol Mg��CO2����ȫȼ�գ�ת�Ƶ�����Ϊ0.02NA |
| C����״���£�3.2g Cu��������Ũ���ᷴӦ��������ķ�����Ϊ0.2NA |
| D��7.8g Na2O2���е���������Ϊ0.2NA |
����˵����ȷ���ǣ�������
| A����ⱥ��ʳ��ˮʱ����Һ�е�OH-�������ƶ� |
| B�����ۼ��ȿ��Դ����ڻ������ֿ��Դ����ڵ����� |
| C��Cl2��SO2������Ư����ɫ���ʣ���Ư��ԭ����ͬ |
| D����������Na��Mg��Fe��һ����������ˮ��Ӧ������H2����Ӧ�ļ� |
 ���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺
���ԭ���ڻ�ѧ��ҵ���й㷺Ӧ�ã���ͼ��ʾһ�����أ�װ�е��Һa��X��Y������缫�壬ͨ��������ֱ����Դ��������ش��������⣺