题目内容
已知:C(s,石墨) == C(s,金刚石) ΔH = +1.9 kJ·mol-1。下列有关说法正确的是
- A.相同条件下,1 mol石墨比1 mol金刚石能量高
- B.断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量少
- C.若:C(s,石墨) + O2(g)==CO2(g) ΔH1=-393.5 kJ?mol-1
则有:C(s,金刚石) + O2(g)==CO2(g)ΔH2=-395.4 kJ·mol-1 - D.其他条件不变时,加入合适的催化剂,可实现该反应的反应热转变为ΔH<0
试题分析:A、从题设条件中的化学方程式可以看出,在相同的条件下,1mol石墨转化为金刚石,要吸收1.9kJ的能量,说明石墨的能量低于金刚石的能量,石墨更稳定.金刚石的能量高,错误;B、石墨的键能比金刚石的键能高,因此,断裂1mol石墨中的化学键吸收的能量比断裂1mol金刚石中的化学键吸收的能量要多,错误;C、从题意来看,1mol C(s,金刚石)自身具有的能量比1mol C(s,石墨)自身具有的能量要高1.9 kJ·mol-1,燃烧时,1mol C(s,金刚石)放出的热量要比1mol C(s,石墨)要多1.9 kJ,正确;D、对于一个确定的化学反应,化学反应的焓变(ΔH)是确定的,不随着外界条件的改变而改变,错误。
考点:考查化学反应中的能量变化、焓变的含义。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案(6分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H22NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-ckJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变 :△H=_________。
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同 |
| C.已知:①2H2(g)+O2(g)===2H2O(g)ΔH1=-a kJ·mol-1, ②2H2(g)+O2(g)===2H2O(l)ΔH2=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1, |
(6分)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
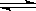 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l) △H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l) △H3=-ckJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变 :△H=_________。
(1)8g液态的CH3OH在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出Q kJ的热量。试写出液态CH3OH燃烧热的热化学方程式 。
(2)在化学反应过程中,破坏旧化学键需要吸收能量,形成新化学键又会释放能量。
|
化学键 |
H—H |
N—H |
N≡N |
|
键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2=2NH3 ΔH=a KJ/mol。
试根据表中所列键能数据计算a的数值为: 。
(3)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599 kJ/mol
根据盖斯定律,由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式: 。