题目内容
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4=H++HSO4-,HSO4- H++SO42-。
H++SO42-。
请回答下列有关问题:
(1)Na2SO4溶液呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是__________________________________________。(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为_________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
| A.c(Na+)=c(SO42-)+c(HSO4-)+c(H2SO4) |
| B.c(OH-)=c(HSO4-)+c(H+) |
| C.c(Na+)+c(H+)=c(OH-)+c(HSO4-)+2c(SO42-) |
| D.c(Na+)=2c(SO42-)+2c(HSO4-) |
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO42-)=________ mol·L-1。
(1)弱碱性 SO42-+H2O HSO4-+OH-
HSO4-+OH-
(2)Ba2++HSO4-=BaSO4↓+H+
(3)BCD
(4)< H2SO4=HSO4-+H+,电离出的H+抑制HSO4-的电离
(5)0.01
解析

现有浓度均为0.1 mol·L-1的下列溶液:
①硫酸;②醋酸溶液;③氢氧化钠溶液;④氯化铵溶液;⑤醋酸铵溶液;⑥硫酸铵溶液;⑦硫酸氢铵溶液;⑧氨水。请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________。
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是________。
| A.c(Na+)=c(Cl-)>c(OH-)>c(NH4+) |
| B.c(Na+)=0.1 mol·L-1 |
| C.c(Na+)+c(NH4+)=c(Cl-)+c(OH-) |
| D.c(H+)>c(OH-) |
A、B、C、D分别是HNO3、Ba(NO3)2、NH4Cl、NaOH四种溶液中的一种。欲将它们一一鉴别,甲、乙、丙分别提出如下方案,请回答有关问题:
(1)甲同学用物质X一次性鉴别上述四种物质,他将适量的X溶液分别加入到四种溶液中,结果发现:C溶液变为棕黄色;B溶液中有白色沉淀产生;D溶液中有能使湿润的红色石蕊试纸变蓝的气体产生,同时产生白色沉淀,最终变为红褐色。
B的化学式是________;D的电子式是________;X的化学式是________;A溶液中水的电离程度________(填“大于”、“小于”或“等于”)C溶液中水的电离程度。
(2)乙同学提出用明矾来鉴别上述四种物质,写出能检验出NH4Cl溶液所涉及的所有离子方程式:Ba2++SO42-=BaSO4↓、________________________。
(3)丙同学用MgSO4来鉴别上述四种溶液,在生成的白色沉淀Mg(OH)2中分别加入HNO3和NH4Cl溶液时,发现沉淀均溶解。有以下两种解释,同时提供下表数据:
A.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+水解产生H+的缘故。
B.NH4Cl溶液能使Mg(OH)2溶解,主要是NH4+结合OH-的缘故。
| 0.01 mol·L-1 电解质溶液 | HF | CH3COOH | HCN | NH3·H2O |
| 酸中H+或碱 中OH-的浓度/mol·L-1 | 8.00×10-4 | 1.32×10-4 | 1.00×10-4 | 1.33×10-4 |
若要证明A和B哪一种解释正确,可以在生成的Mg(OH)2沉淀中加入一种物质,这种物质的化学式为__________________。
依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)="0.02" mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液的pH大于 。
以下是25℃时几种难溶电解质的溶解度:
| 难容电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些离子。例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,加入一定量的试剂反应,过滤后结晶。
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的Mg(OH)2,充分反应,过滤后结晶。
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤后结晶。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe2+、Fe3+都被转化为 而除去。
(2)①中加入的试剂应该选择 为宜。
(3)②中除去Fe3+所发生的总反应的离子方程式为 。
(4)下列与方案③相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在

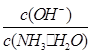 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。