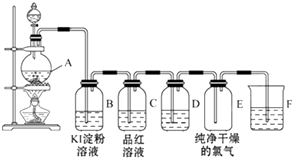
题目内容
【题目】将Mg、Cu组成的2.64g混合物投入到100mL稀硝酸中完全溶解,并收集还原产物NO气体(还原产物只有一种).然后向反应后的溶液中逐滴加入2molL﹣1NaOH溶液,下图是生成沉淀的质量与滴入NaOH溶液体积间的关系图.以下说法不正确的是( ) 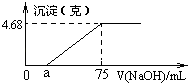
A.稀硝酸的浓度为1.9 mol/L
B.生成的NO在标况下的体积为0.896 L
C.a的值为15 mL
D.Cu的物质的量为0.02 mol
【答案】D
【解析】解:由图可知,滴加氢氧化钠溶液,开始没有沉淀生成,故硝酸有剩余,加入75mL氢氧化钠溶液,沉淀为最大值,此时溶液中溶质为NaNO3 , 沉淀的质量为4.68g,故沉淀含有氢氧根离子的质量为4.68g﹣2.64g=2.04g,物质的量为0.12mol,根据电荷守恒可知,金属提供的物质的量为0.12mol,根据电子转移守恒可知,生成NO的物质的量为 ![]() =0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知,
=0.04mol,令金属中Mg的物质的量为xmol,Cu的物质的量为ymol,根据二者质量之和与提供的电子可知, ![]() ,故x=0.03mol,y=0.03mol,
,故x=0.03mol,y=0.03mol,
A、原硝酸的物质的量为n(NaNO3)+n(NO)=n(NaOH)+n(NO)=0.075L×2molL﹣1+0.04mol=0.19mol,故原硝酸的物质的量浓度为 ![]() =1.9mol/L,故A正确;
=1.9mol/L,故A正确;
B、生成NO的物质的量为0.04mol,标准状况下体积为0.04mol×22.4L/mol=0.896L,故B正确;
C、金属混合物中Cu、Mg的物质的量都为0.03mol,利用元素守恒可知,铜离子、镁离子消耗的氢氧根离子的物质的量为0.06mol×2=0.12mol,消耗的氢氧化钠的体积为 ![]() =0.06L=60mL,故a=75﹣60=15,故C正确;
=0.06L=60mL,故a=75﹣60=15,故C正确;
D、由上述分析可知,Cu的物质的量为0.03mol,故D错误;
故选D.