题目内容
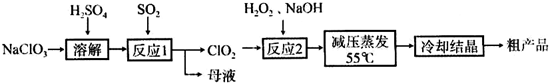
某课外研究小组,用铜粉通过不同的化学反应制取胆矾.其设计的实验过程如图所示:

(1)过程①采用灼烧的方法,灼烧时用到的仪器是______(填字母).
a.量筒b.漏斗c.坩埚d.蒸发皿
(2)铜粉经灼烧后得到的产物是氧化铜及少量铜的混合物,判断其中含有少黄铜的方法是______.
(3)途径Ⅰ中的氧化还原反应化学方程式是______.
(4)过程②的操作是:蒸发浓缩、冷却______,过滤.
(5)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是______、______.

(1)过程①采用灼烧的方法,灼烧时用到的仪器是______(填字母).
a.量筒b.漏斗c.坩埚d.蒸发皿
(2)铜粉经灼烧后得到的产物是氧化铜及少量铜的混合物,判断其中含有少黄铜的方法是______.
(3)途径Ⅰ中的氧化还原反应化学方程式是______.
(4)过程②的操作是:蒸发浓缩、冷却______,过滤.
(5)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径Ⅱ有明显的两个优点是______、______.
(1)由于灼烧需要在坩埚中完成,用到的仪器为c坩埚,故答案为:c;
(2)可以根据铜不溶于稀盐酸设计方案检验,所以检验方法为:取少量粗制氧化铜于试管中,加入足量盐酸,充分振荡,若有不溶物存在,说明粗制氧化铜中含有少量铜,
故答案为:取少量粗制氧化铜于试管中,加入足量盐酸,充分振荡,若有不溶物存在,说明粗制氧化铜中含有少量铜;
(3)途径Ⅰ的反应是铜与浓硫酸加热反应,反应的方程式为:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
(4)过程②硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤等操作,最后得到胆矾,
故答案为:结晶;
(5)根据化学方程式:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;2Cu+2H2SO4+O2═2CuSO4+2H2O;比较与途径1相比,途径2有明显的两个优点,从反应物的质量和产物中的污染物的排放等方面答,
故答案为:产生等量胆矾途径 II消耗硫酸少;途径 II不会产生污染大气的气体.
(2)可以根据铜不溶于稀盐酸设计方案检验,所以检验方法为:取少量粗制氧化铜于试管中,加入足量盐酸,充分振荡,若有不溶物存在,说明粗制氧化铜中含有少量铜,
故答案为:取少量粗制氧化铜于试管中,加入足量盐酸,充分振荡,若有不溶物存在,说明粗制氧化铜中含有少量铜;
(3)途径Ⅰ的反应是铜与浓硫酸加热反应,反应的方程式为:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
故答案为:Cu+2H2SO4(浓)
| ||
(4)过程②硫酸铜溶液经过蒸发浓缩、冷却结晶、过滤等操作,最后得到胆矾,
故答案为:结晶;
(5)根据化学方程式:Cu+2H2SO4(浓)
| ||
故答案为:产生等量胆矾途径 II消耗硫酸少;途径 II不会产生污染大气的气体.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目