题目内容
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
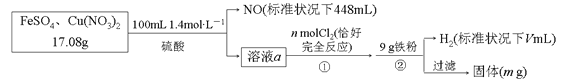
下列叙述中不正确的是
A.n=0.02 B.V=2240
C.m=3.2 D.原混合物中FeSO4的质量分数约为89%
【答案】C
【解析】步骤②中加入铁粉后有H2生成,说明前面所加硫酸过量,溶液a能与Cl2反应,说明含有Fe2+,即加稀硫酸反应后,Fe2+有剩余;则加入稀硫酸时发生的反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中NO3全部被还原为NO,根据元素守恒由n(NO)=0.02 mol可得样品中m[Cu(NO3)2]=0.01 mol×188 g·mol1=1.88 g,则m(FeSO4)=17.08 g1.88 g=15.20 g,其物质的量n(FeSO4)=0.1 mol,原混合物中FeSO4的质量分数为![]() ,故D正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06 mol,则溶液a中的Fe2+为0.04 mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化0.04 mol Fe2+需要0.02 mol Cl2,即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的H+为0.08 mol,则溶液a中的H+为0.14 mol×20.08 mol=0.2 mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1 mol Fe3+,溶液a中还有0.01 mol Cu2+;反应2Fe3++Fe==3Fe2+消耗0.05 mol Fe,反应Cu2++Fe==Cu+Fe2+消耗0.01 mol Fe,同时生成0.01 mol Cu,反应Fe+2H+==Fe2++H2↑消耗0.1 mol Fe,生成0.1 mol H2,标准状况下H2体积为2240 mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56 g·mol1=0.04 g,则最后过滤所得固体质量m=(0.64+0.04) g=0.68 g,故C不正确。
,故D正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的Fe2+为0.06 mol,则溶液a中的Fe2+为0.04 mol,根据反应2Fe2++Cl2==2Fe3++2Cl可知,氧化0.04 mol Fe2+需要0.02 mol Cl2,即n=0.02,故A正确。反应3Fe2++NO3+4H+==3Fe3++NO↑+2H2O中消耗的H+为0.08 mol,则溶液a中的H+为0.14 mol×20.08 mol=0.2 mol,根据铁元素守恒可知溶液a通入Cl2后含有0.1 mol Fe3+,溶液a中还有0.01 mol Cu2+;反应2Fe3++Fe==3Fe2+消耗0.05 mol Fe,反应Cu2++Fe==Cu+Fe2+消耗0.01 mol Fe,同时生成0.01 mol Cu,反应Fe+2H+==Fe2++H2↑消耗0.1 mol Fe,生成0.1 mol H2,标准状况下H2体积为2240 mL,故B正确。通过以上分析可知,生成的Cu的质量为0.64 g,剩余Fe的质量为9 g(0.05+0.01+0.1) mol×56 g·mol1=0.04 g,则最后过滤所得固体质量m=(0.64+0.04) g=0.68 g,故C不正确。






