��Ŀ����
����Ŀ����ͼΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã��ش��������⣺

��1��������Ԫ�ص�����������Ӧ��ˮ�����У�����ǿ�����_______���û�ѧʽ��ʾ����ͬ����������ǿ����_______��
��2���ܡ��ݡ��ļ����Ӱ뾶�ɴ�С��˳����_______�������ӷ��ű�ʾ��
��3�����������ӻ�������ɢ١��ܡ��ݡ�������Ԫ����ɣ����������ʿ���ˮ��Һ�з�����Ӧ��дɽ�÷�Ӧ�����ӷ���ʽ��_______________��
��4����д���漰�����й�Ԫ�ص������û���Ӧ��Ҫ��ͬһ��Ӧ�����ֵ��ʶ�ӦԪ�ؼȲ�ͬ����Ҳ��ͬ���壩__________________��_____________��
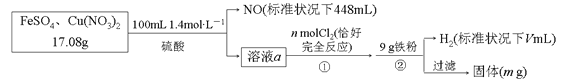
��5���ɱ���Ԫ���γɵij�����������A��B��C��X������ת����ϵ��

��A��B��C��ͬһ����Ԫ�أ�XΪǿ����ʣ��ҷ�Ӧ������Һ�н��У���B�Ļ�ѧʽΪ_____��X�Ļ�ѧʽ����Ϊ______��______��д��ͬ������ʣ���
���𰸡� H2SO4��HNO3 NaOH O2->Na+>Mg2+ H++HSO3-=SO2+H2O 2Mg+CO2=C+2MgO Mg+H2SO4=MgSO4+H2 Al(OH)3 NaOH H2SO4��HNO3��
����������Ԫ�������ڱ��е�λ�ÿ�֪������H������C������N������O������Na������Al������Si������S��
��1��������Ԫ�ص�����������Ӧ��ˮ�����У�����ǿ�����H2SO4��HNO3��������ǿ����NaOH��
��2�����Ӳ���ͬ�����ӣ��˵����Խ��Mg����������Ӱ뾶ΪO2-��Na+��Mg2+��
��3�����ӻ�����ΪNaHSO3��NaHSO4�����߷�Ӧ���������ơ�ˮ�������������ӷ�ӦΪH++HSO3-=SO2+H2O��
��4������ͬһ��Ӧ�����ֵ��ʶ�ӦԪ�ؼȲ�ͬ����Ҳ��ͬ������û���Ӧ����Mg�û�C��Mg�û�H����Ӧ�ֱ�Ϊ2Mg+CO2![]() C+2MgO��Mg+H2SO4=MgSO4+H2����
C+2MgO��Mg+H2SO4=MgSO4+H2����
��5��A��B��C��ͬһ����Ԫ�أ�XΪǿ����ʣ���ͼ��������Ӧ��֪����AΪ���Σ�XΪNaOH����AΪƫ�����Σ�XΪǿ�ᣨ��H2SO4��HNO3����B��ΪAl��OH��3��

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�����Ŀ��������������һ������Ư�������������㷺Ӧ����ũҵ��ҽҩ�����û������������õ�Ũ�ȵ�˫��ˮ�ͱ���������Һ��һ�������¿��Ժϳɹ�������������Ӧ�ķ���ʽΪ��
CO(NH2)2+H2O2![]() CO(NH2)2��H2O2�����������صIJ����������£�
CO(NH2)2��H2O2�����������صIJ����������£�
����ʽ | ��� | �ȷֽ��¶� | �۵� | �ܽ��� |
CO(NH2)2��H2O2 | ��ɫ���� | 45�� | 75��85�� | ������ˮ���л��ܼ� |
�ϳɹ��������ص����̼���Ӧװ��ͼ��ͼ��

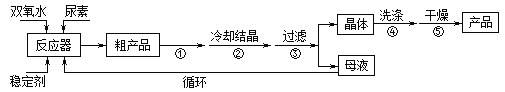
��ش��������⣺
��1������X��������__________������������ȴˮ��____���a����b�����ڳ�����
��2���÷�Ӧ���¶ȿ���30������ܹ��ߵ�ԭ����_______________________��
��3���������˲��õIJ�����_____________��
A���������� B����ѹ���� C����ѹ����
��4����ʵ�����Ƶ������þ��壬���˺���Ҫ����ˮϴ�ӣ������ϴ�Ӳ�����_________________��
��5��ȷ��ȡ1.000g��Ʒ��250mL��ƿ�У�����������ˮ�ܽ⣬�ټ�2mL6mol��L��1H2SO4����0.2000mol��L��1KMnO4����Һ�ζ����յ�ʱ����18.00mL��������KMnO4��Һ����Ӧ�������Ʒ��CO(NH2)2��H2O2����������Ϊ_____________�����ζ����Ӷ��������õĹ��������غ���________���ƫ�ߡ�����ƫ�͡����䡱����