��Ŀ����
����Ŀ����Ba��OH��2��Һ����μ���ϡ���ᣬ������������⣺
��1��д����Ӧ�����ӷ���ʽ ��
��2��������������£����ӷ���ʽ�루1����ͬ���� ������ţ���
A.��NaHSO4��Һ�У���μ���Ba��OH��2��Һ����Һ������
B.��NaHSO4��Һ�У���μ���Ba��OH��2��Һ��SO ![]() ǡ����ȫ����
ǡ����ȫ����
C.��NaHSO4��Һ�У���μ���Ba��OH��2��Һ������
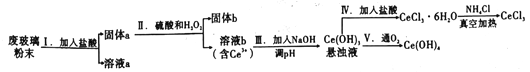
��3������������ϡ����ֱ�����������������л����Һ�ĵ����������õ���ǿ��I��ʾ���ɽ��Ƶ���ͼ1�е����߱�ʾ������ţ��� 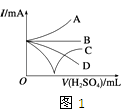
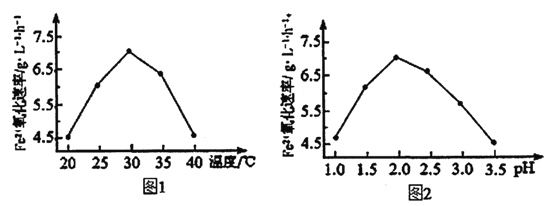
��4������һ����⻬������С��������Ba��OH��2��Һ���룬��ͼ2��ʾ������ձ��ﻺ��ע����Ba��OH��2��Һ���ܶȵ�ϡ������ǡ����ȫ��Ӧ���ڴ�ʵ������У�С�� �� 
���𰸡�
��1��Ba2++2OH��+SO42��+2H+�TBaSO4��+2H2O
��2��A
��3��C
��4�������ձ��ײ�
���������⣺��1����Ӧ�������ᱵ��ˮ�������ӷ�ӦΪBa2++2OH��+SO42��+2H+�TBaSO4��+2H2O���ʴ�Ϊ��Ba2++2OH��+SO42��+2H+�TBaSO4��+2H2O����2�����ӷ���ʽ��1����Ӧ����ҺΪ���ԣ�A����NaHSO4��Һ�У���μ���Ba��OH��2��Һ����Һ�����ԣ����ӷ�ӦΪBa2++2OH��+SO42��+2H+�TBaSO4��+2H2O����Aѡ�� B����NaHSO4��Һ�У���μ���Ba��OH��2��Һ��SO42��ǡ����ȫ���������ӷ�ӦΪBa2++OH��+SO42��+H+�TBaSO4��+H2O����B��ѡ��C����NaHSO4��Һ�У���μ���Ba��OH��2��Һ�����������ӷ�ӦΪBa2++OH��+SO42��+H+�TBaSO4��+H2O����C��ѡ���ʴ�Ϊ��A����3������ϡ����ֱ��������ǡ�÷�Ӧʱ������Ϊ0������������Ũ������������ǿ��ͼ��ֻ��C���ϣ��ʴ�Ϊ��C�� ��4������ձ��ﻺ��ע����Ba��OH��2��Һ���ܶȵ�ϡ������ǡ����ȫ��Ӧ���������ᱵ��ˮ����Һ���ܶ�С��Ba��OH��2��Һ���ܶȣ�����С�����ձ��ײ���
�ʴ�Ϊ�������ձ��ײ���
��1����Ӧ�������ᱵ��ˮ�����ᱵ��ˮ�����ӷ�Ӧ�о�������ѧʽ����2��ǡ����ȫ��Ӧʱ����ҺΪ���ԣ���3������ϡ����ֱ��������ǡ�÷�Ӧʱ������Ϊ0������������Ũ������������ǿ����4������ձ��ﻺ��ע����Ba��OH��2��Һ���ܶȵ�ϡ������ǡ����ȫ��Ӧ���������ᱵ��ˮ����Һ���ܶ�С��Ba��OH��2��Һ���ܶȣ��Դ������

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�