题目内容
安徽省从2013年12月1日零时起,车用汽油升级为“国Ⅳ”标准,汽油中的硫含量下降三分之二,对二氧化硫的排放有了大大的改善,SO2可以用Fe( NO3)3溶液吸收,某化学兴趣小组对SO2和 Fe( NO3)3溶液的反应[0.1mol/L的Fe(NO3)3溶液的 pH=2]做了相应探究。
探究I
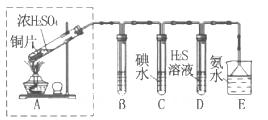
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。
①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
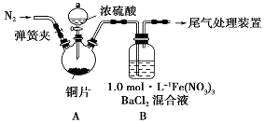
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
探究I
(1)某同学进行了下列实验:取12.8g铜片和20 mL 18 mol?L-1的浓硫酸放在三颈瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余,同时根据所学的知识同学们认为还有较多的硫酸剩余。

①配制1mol/L 的Fe(NO3)3溶液,需准确称量一定质量的Fe(NO3)3固体,在烧杯中溶解恢复到室温后,将溶液转移到容量瓶中,再经过洗涤、定容、摇匀可配得溶液,请回答将溶液转移至容量瓶中的操作方法________________________________。
②装置A中反应的化学方程式是_________________________________________。
③该同学设计求余酸的物质的量实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是______ (填字母)。
A.将产生的气体缓缓通过预先称量的盛有碱石灰的干燥管,结束反应后再次称重
B.将产生的气体缓缓通入足量Na2S溶液后,测量所得沉淀的质量
C.用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)
探究II
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是____________________。
(3)装置B中产生了白色沉淀,分析B中产生白色沉淀的原因,提出下列三种猜想:
猜想1: SO2与Fe3+反应;
猜想2:在酸性条件下SO2与NO3-反应;
猜想3:____________________________________;
①按猜想1,装置B中反应的离子方程式是______________________________,证明该猜想1中生成的还原产物,某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去,请分析该同学做法是否正确_________(填“正确”或“不正确”),理由是__________________________________。
②按猜想2,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列某种溶液,在相同条件下进行实验。应选择的替换溶液是______ (填序号)。
A.1 mol/L 稀硝酸
B.pH=1的FeCl3溶液
C.6.0mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
(1)①用玻璃棒引流,玻璃棒的底部要在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口
②2H2SO4(浓)+Cu CuSO4+2H2O+2SO2↑
CuSO4+2H2O+2SO2↑
③A
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
(3)猜想3:SO2和Fe3+、酸性条件下NO3-都反应
①Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+
也可分步写SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓
不正确 SO2也可以使酸性高锰酸钾褪色
②C.
②2H2SO4(浓)+Cu
 CuSO4+2H2O+2SO2↑
CuSO4+2H2O+2SO2↑ ③A
(2)打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
(3)猜想3:SO2和Fe3+、酸性条件下NO3-都反应
①Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+
也可分步写SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓
不正确 SO2也可以使酸性高锰酸钾褪色
②C.
试题分析:(1)在配制物质的量浓度的溶液时,将溶液从烧杯转移至容量瓶中的操作方法是①用玻璃棒引流,将玻璃棒的底部插在容量瓶的刻度线以下且玻璃棒不能碰到容量瓶口。②装置A中浓硫酸与Cu反应的化学方程式是2H2SO4(浓)+Cu
 CuSO4+2H2O+2SO2↑ 。③A.产生的气体SO2中含有水蒸气,所以盛有碱石灰的干燥管,吸收的质量为SO2和水蒸气的质量和。因此,不能准确测定产生气体的量。错误。B.在溶液中发生反应:SO2+H2O=H2SO3,H2SO3+Na2S=H2S+ Na2SO3. SO2+ 2H2S=3S↓+H2O.所以可根据测量所得沉淀的质量来计算放出的SO2气体的量。正确。C.SO2气体在用排饱和NaHSO3溶液不能溶解,因此可以用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)。正确。(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是打开弹簧夹,向装置中通入一段时间的N2,待空气完全逸出后再关闭弹簧夹。(3)猜想3:SO2与Fe3+反应;在酸性条件下SO2与NO3-反应都发生。①按猜想1,装置B中反应的离子方程式为:SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓。总方程式为:Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+。某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去就证明含有Fe2+的作法不正确,原因是SO2也有还原性,也能使酸性高锰酸钾溶液褪色。②若想在酸性条件下SO2与NO3-反应,只要提供酸性环境及NO3-即可。不需要Fe3+的存在。A是硝酸,硝酸有强的氧化性,不能说明问题。错误。B.仍然含有Fe3+的.还有干扰。错误。C. 同时提供酸性环境及NO3-。符合条件。正确。2对大气污染的测定、治理及化学方程式、离子方程式的书写等知识。
CuSO4+2H2O+2SO2↑ 。③A.产生的气体SO2中含有水蒸气,所以盛有碱石灰的干燥管,吸收的质量为SO2和水蒸气的质量和。因此,不能准确测定产生气体的量。错误。B.在溶液中发生反应:SO2+H2O=H2SO3,H2SO3+Na2S=H2S+ Na2SO3. SO2+ 2H2S=3S↓+H2O.所以可根据测量所得沉淀的质量来计算放出的SO2气体的量。正确。C.SO2气体在用排饱和NaHSO3溶液不能溶解,因此可以用排饱和NaHSO3溶液的方法测定其产生气体的体积(折算成标准状况)。正确。(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是打开弹簧夹,向装置中通入一段时间的N2,待空气完全逸出后再关闭弹簧夹。(3)猜想3:SO2与Fe3+反应;在酸性条件下SO2与NO3-反应都发生。①按猜想1,装置B中反应的离子方程式为:SO2+2 Fe3++2H2O=SO42-+4H++2 Fe2+,Ba2++SO42-=BaSO4↓。总方程式为:Ba2++SO2+2 Fe3++2H2O=BaSO4↓+4H++2 Fe2+。某同学取少量溶液滴加几滴酸性高锰酸钾溶液,紫红色褪去就证明含有Fe2+的作法不正确,原因是SO2也有还原性,也能使酸性高锰酸钾溶液褪色。②若想在酸性条件下SO2与NO3-反应,只要提供酸性环境及NO3-即可。不需要Fe3+的存在。A是硝酸,硝酸有强的氧化性,不能说明问题。错误。B.仍然含有Fe3+的.还有干扰。错误。C. 同时提供酸性环境及NO3-。符合条件。正确。2对大气污染的测定、治理及化学方程式、离子方程式的书写等知识。
练习册系列答案
相关题目


 HSO3—+OH—,所以滴入酚酞变红;
HSO3—+OH—,所以滴入酚酞变红; 8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。
8SO2+2Fe2O3该反应中被氧化的元素是_______(填元素符号)。当该反应转移2. 75mol电子时,生成的二氧化硫在标准状况下的体积为_______L。