题目内容
在120 ℃、1.01×105 Pa时,4.76 g二氧化碳和水蒸气的混合气体,缓慢通入 37.16 g足量过氧化钠中,充分反应,固体物质的质量变为 40 g。
求:(1)混合气体中二氧化碳和水蒸气的物质的量。
(2)若将上述 4.76 g混合气体通入 60 mL 2 mol ·L-1氢氧化钠溶液中,充分 反应后,求生成物的物质的量。
求:(1)混合气体中二氧化碳和水蒸气的物质的量。
(2)若将上述 4.76 g混合气体通入 60 mL 2 mol ·L-1氢氧化钠溶液中,充分 反应后,求生成物的物质的量。
(1)混合气体中含CO2 0.1 mol ,水蒸气0.02 mol。
(2)生成物中Na2CO3 0. 02 mol,NaHCO3 0. 08 mol。
(2)生成物中Na2CO3 0. 02 mol,NaHCO3 0. 08 mol。
(1)设混合气体中CO2、H2O的物质的量分别为x、y。
2Na2O2+2CO2="=== " 2Na2CO3+O2 固体净增
2 mol 1 mol 56 g
2Na2O2+2H2O====4NaOH+O2↑ 固体净增
2 mol 1 mol 4 g
解得x="0.1 " mol y="0.02" mol
(2)NaOH和CO2的反应为:
2NaOH+CO2====Na2CO3+H2O
NaOH+CO2====NaHCO3
n(NaOH)="2" mol·L-1×0.06 L="0.12" mol
n(CO2)=" 0.1" mol
两者之比介于2∶1和1∶1之间,故生成物为Na2CO3和NaHCO3。
2NaOH + CO2 ="===" Na2CO3+H2O
2 mol 1 mol 1 mol
0.12 mol 0.06 mol 0.06 mol
Na2CO3 + CO2 + H2O====2NaHCO3
1 mol 1 mol 2 mol
0.04 mol 0.04 mol 0.08 mol
生成Na2CO3的物质的量="0.06" mol -0.04 mol ="0.02" mol ,NaHCO3为 0.08 mol。
2Na2O2+2CO2="=== " 2Na2CO3+O2 固体净增
2 mol 1 mol 56 g
2Na2O2+2H2O====4NaOH+O2↑ 固体净增
2 mol 1 mol 4 g
解得x="0.1 " mol y="0.02" mol
(2)NaOH和CO2的反应为:
2NaOH+CO2====Na2CO3+H2O
NaOH+CO2====NaHCO3
n(NaOH)="2" mol·L-1×0.06 L="0.12" mol
n(CO2)=" 0.1" mol
两者之比介于2∶1和1∶1之间,故生成物为Na2CO3和NaHCO3。
2NaOH + CO2 ="===" Na2CO3+H2O
2 mol 1 mol 1 mol
0.12 mol 0.06 mol 0.06 mol
Na2CO3 + CO2 + H2O====2NaHCO3
1 mol 1 mol 2 mol
0.04 mol 0.04 mol 0.08 mol
生成Na2CO3的物质的量="0.06" mol -0.04 mol ="0.02" mol ,NaHCO3为 0.08 mol。

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目

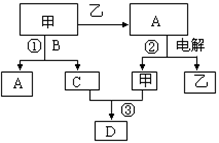
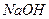 溶液,生成沉淀的物质的量与加入
溶液,生成沉淀的物质的量与加入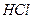 的发挥,则下列说法正确的是( )
的发挥,则下列说法正确的是( )