题目内容
在一定的温度下,下列叙述与图象对应正确的是( )
A、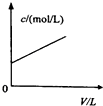 如图中曲线可表示向0.1mol/L CH3COONa溶液中加水稀释的过程中OH-浓度随溶液体积的变化趋势 | B、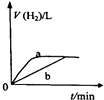 如图中曲线a、b分别表示过量纯锌、过量粗锌(含Cu、C杂质)跟同浓度等体积盐酸反应过程中产生H2体积的变化趋势 | C、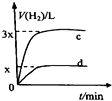 如图中曲线c、d分别表示等质量的铝分别跟过量烧碱溶液、过量盐酸反应过程中产生H2体积的变化趋势 | D、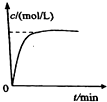 如图中曲线可表示足量锌与一定量稀醋酸反应过程中,Zn2+浓度的变化趋势(假设反应过程中溶液体积保持不变) |
分析:A.向0.1mol/L CH3COONa溶液中加水稀释,促进CH3COO-的水解,但OH-浓度降低;
B.粗锌形成原电池反应,反应速率较大;
C.等质量的铝分别跟过量烧碱溶液、过量盐酸反应生成氢气的体积相同;
D.随着反应进行,醋酸浓度逐渐降低,反应速率逐渐减小.
B.粗锌形成原电池反应,反应速率较大;
C.等质量的铝分别跟过量烧碱溶液、过量盐酸反应生成氢气的体积相同;
D.随着反应进行,醋酸浓度逐渐降低,反应速率逐渐减小.
解答:解:A.向0.1mol/L CH3COONa溶液中加水稀释,促进CH3COO-的水解,由于体积增大,OH-浓度反而降低,故A错误;
B.粗锌形成原电池反应,反应速率较大,曲线斜率应较大,故B错误;
C.等质量的铝分别跟过量烧碱溶液、过量盐酸反应,由于铝反应后生成的含铝化合物中铝的化合价都为+3价,则铝失电子数相等,所以生成氢气的体积相同,故C错误;
D.随着反应进行,醋酸浓度逐渐降低,反应速率逐渐减小,则锌离子的浓度变化曲线正确,故D正确.
故选D.
B.粗锌形成原电池反应,反应速率较大,曲线斜率应较大,故B错误;
C.等质量的铝分别跟过量烧碱溶液、过量盐酸反应,由于铝反应后生成的含铝化合物中铝的化合价都为+3价,则铝失电子数相等,所以生成氢气的体积相同,故C错误;
D.随着反应进行,醋酸浓度逐渐降低,反应速率逐渐减小,则锌离子的浓度变化曲线正确,故D正确.
故选D.
点评:本题考查较为综合,涉及盐类的水解、原电池反应以及弱电解质的电离等知识,为高频考点,侧重于学生的分析能力和比较能力的考查,注意把握物质的性质以及影响盐类水解的因素,注重相关基础知识的积累,难度中等.

练习册系列答案
相关题目
合成氨反应为:N2(g)+3H2(g)?2NH3(g).图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线.图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响.

下列说法正确的是( )

下列说法正确的是( )
| A、该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 | B、图2中0~10min内该反应的平均速率v(H2)=0.045mol?L-1?min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | C、图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | D、图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |