题目内容
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是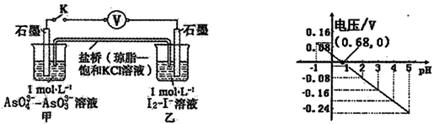
A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
C
解析试题分析:A、由右图可知,pH>0.68时,电压小于0,反应逆向进行,pH<0.68时,电压大于0,反应正向进行,所以调节pH可以改变反应的方向,正确;B、pH=0.68时,电压为零,反应处于平衡状态,正确;C、pH=5时,电压小于0,反应逆向进行,AsO33-在负极失电子,则负极电极反应式为AsO33--2e-+H2O=AsO43-+2H+,错误;D、pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,正确,答案选C。
考点:考查原电池反应原理及化学平衡的移动

Cl2是纺织工业中常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”, S2O32-与Cl2反应的产物之一为SO42一。下列说法中,错误的是 ( )
| A.该反应中的氧化剂是C12 |
| B.SO2与氯水的漂白原理相同,所以可用S02做纺织工业的漂白剂 |
| C.上述反应中,每生成1 mol SO42一,可脱去2 mol C12 |
| D.根据该反应可判断还原性:S2O32->C1— |
随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是
| A.无水硫酸铜、蔗糖 | B.硅胶、硫酸亚铁 |
| C.食盐、硫酸亚铁 | D.生石灰、食盐 |
已知在热的碱性溶液中,NaClO能发生如下反应:3NaClO=2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,则其最终产物是
| A.NaCl、NaClO | B.NaCl、NaClO3 | C.NaClO、NaClO3 | D.NaClO2、NaClO4 |
宋代著名法医学家宋慈 的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2="==2" Ag2S +2H2O,其中H2S是
| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
下面有关氧化还原反应的叙述不正确的是 ( )
| A.氧化还原反应的本质是电子的转移 |
| B.在氧化还原反应中,失去电子的物质,一定有元素化合价升高 |
| C.肯定有一种元素被氧化,另一种元素被还原 |
| D.在反应中不一定所有元素的化合价都发生变化 |
已知:2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O;Cl2+2FeCl2===2FeCl3;
2KI+2FeCl3===2KCl+I2+2FeCl2。则下列判断错误的是
A.氧化性:MnO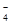 >Cl2>Fe3+ >I2 >Cl2>Fe3+ >I2 |
| B.FeCl3既有氧化性又有还原性 |
| C.向FeI2溶液中通入少量的Cl2,发生反应的方程式为6FeI2+3Cl2=2FeCl3+4FeI3 |
| D.FeCl3能使湿润的淀粉碘化钾试纸变蓝 |
下列实验对应的结论正确的是:
| | A | B | C | D |
| 装 置 | 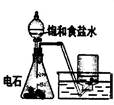 | 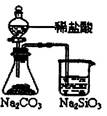 | 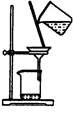 | 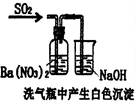 |
| 结 论 | 实验室制取乙炔 | 能证明非金属性 Cl>C>Si | 分离出Cl2与KI溶 液反应生成的碘 | 白色沉淀是BaSO3 |