题目内容
甲、乙两种非金属元素:①甲单质比乙单质容易与H2化合;②甲单质能与乙的简单阴离子反应生成乙的单质;③甲的最高价氧化物对应的水化物酸性比乙的强;④与某金属反应时,甲原子得电子数目比乙的多;⑤甲单质的熔、沸点比乙的低。一般能说明甲比乙的非金属性强的是
| A.只有④ | B.只有⑤ |
| C.①②③ | D.①②③④⑤ |
C
解析

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
已知短周期元素R、W、X、Y、Z的原子序数依次增大,其氢化物中上述元素的化合价如下表,下列说法正确的是( )
| 元素 | R | W | X | Y | Z |
| 化合价 | –4 | +1 | –4 | –2 | –1 |
A.离子还原性:Y2->Z-
B.离子半径W+>Z-
C.气态氢化物稳定性:RH4<XH4
D.酸性:H2YO4<HZO4
下表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中正确的是( )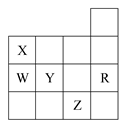
| A.常温常压下,五种元素的单质中有两种是气态 |
| B.Y、Z的阴离子的电子层结构都与R原子的相同 |
| C.X的氢化物与其最高价氧化物对应的水化物形成的盐溶液呈碱性 |
| D.Y元素最高价氧化物对应的水化物的酸性比W元素的弱 |
以下说法中,不违背科学规律的是 ( )
①改变核外电子数可使原子与离子相互转化 ②改变核内中子数可使不同的同位素相互转化 ③改变核内质子数可使不同的元素相互转化,属于化学变化 ④改变离子的电荷数可使一种元素的阳离子转化为另一种元素的阴离子
| A.①② | B.②③ | C.③④ | D.①③ |
元素周期律产生的根本原因就是随着元素原子序数的递增
| A.元素的相对原子质量逐渐增大 |
| B.核外电子排布呈周期性变化 |
| C.原子半径呈周期性变化 |
| D.元素主要化合价呈周期性变化 |
下列排列顺序中错误的是( )。
| A.原子半径:O<S<Na |
| B.稳定性:PH3>H2S>NH3 |
| C.酸性:H3PO4<H2SO4<HClO4 |
| D.碱性:Al(OH)3<Mg(OH)2<NaOH |
目前,医疗上使用放射性核素 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A.19 | B.53 | C.72 | D.125 |
关于同一种元素的原子或离子,下列叙述正确的是( )。
| A.原子半径比阴离子半径小 |
| B.原子半径比阴离子半径大 |
| C.原子半径比阳离子半径小 |
| D.带正电荷多的阳离子比带正电荷少的阳离子半径大 |