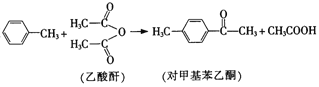
题目内容
【题目】某研究小组为了探究一种无机盐X(仅含有五种元素,且含有结晶水)的组成和性质。设计并完成了如下实验:

另将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224 L。请回答如下问题:
(1)X的化学式是________________, 固体2中存在的化学键类型________________。
(2)溶液2中通入过量气体甲时发生的离子反应方程式:___________________________。
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224 L,写出该反应的化学方程式:___________________________________________。
(4)请设计实验证明无机盐X中存在的金属阳离子____________________________________。
【答案】 (NH4)2SO4·2FeSO4·2H2O 离子键和共价键 H++NH3===NH![]() 、Fe2++2NH3·H2O===Fe(OH)2↓+2NH
、Fe2++2NH3·H2O===Fe(OH)2↓+2NH![]() 2NH3+6CuO===3Cu2O+N2+3H2O 取少量无机盐X于试管中加水溶解,滴加几滴KSCN溶液,无明显现象,再滴加少量氯水,若溶液出现血红色,则证明存在Fe2+(其他合理答案也可)
2NH3+6CuO===3Cu2O+N2+3H2O 取少量无机盐X于试管中加水溶解,滴加几滴KSCN溶液,无明显现象,再滴加少量氯水,若溶液出现血红色,则证明存在Fe2+(其他合理答案也可)
【解析】(1)无机盐X与过量氢氧化钡溶液反应得到气体甲为氨气和固体1,说明X中含有铵根离子,固体1中加入过量盐酸过滤得到固体2为硫酸钡沉淀,证明X中含有硫酸根离子,溶液2中加入过量气体甲氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀,洗涤灼烧得到固体3为1.60g,将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224L,氨气和氧化铜反应生成氮气、铜和水蒸气,通过浓硫酸得到气体为氮气,则依据氮元素守恒,n(NH4+)=2n(N2)=2×![]() =0.02mol,固体2为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol,固体2为硫酸钡,n(SO42-)=n(BaSO4)=![]() =0.03mol,硫酸铵中硫酸根离子为0.01mol,则金属形成的盐中硫酸根离子为0.02mol,洗涤灼烧得到固体3为1.60g为氧化铁质量,物质的量为
=0.03mol,硫酸铵中硫酸根离子为0.01mol,则金属形成的盐中硫酸根离子为0.02mol,洗涤灼烧得到固体3为1.60g为氧化铁质量,物质的量为![]() =0.01mol,含铁元素0.02mol,X的化学式是(NH4)2SO4.2FeSO4.2H2O,固体2为硫酸钡,存在的化学键类型为离子键和共价键;
=0.01mol,含铁元素0.02mol,X的化学式是(NH4)2SO4.2FeSO4.2H2O,固体2为硫酸钡,存在的化学键类型为离子键和共价键;
(2)溶液2中通入过量气体甲时发生的离子反应氨气和过量盐酸反应,生成铵盐,和金属离子反应生成氢氧化物沉淀,反应的离子方程式为:H++NH3=NH4+,Fe2++2NH3.H2O═Fe(OH)2+2NH4+;
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224L为氮气,氨气还原氧化铜为氧化亚铜,反应的化学方程式为:2NH3+6CuO═Cu2O+N2+3H2O;
(4)无机盐X中存在的金属阳离子为亚铁离子,依据亚铁离子检验方法,加入KSCN溶液雾变化,滴入氯水变红色证明,取少量无机盐X于试管中加水溶解,滴加几滴KSCN溶液,无明显现象,再滴加少量氯水,若溶液出现血红色,则证明存在Fe2+。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案