题目内容
7.根据元素周期表1~18号元素的性质和递变规律,用元素符号或者化学式回答下列问题.(1)属于金属元素的有5种,金属性最强的元素与氧反应生成的化合物Na2O、Na2O2;其最高价氧化物对应水化物碱性最强的是NaoH;
(2)最高正化合价最高的元素是Cl,其最高正化合价为+7;
(3)单质既能与HCI反应,又能与NaOH反应的是Al,其最高价氧化物对应水化物具有两性(填“酸性”、“碱性”或“两性”);
(4)非金属性最强的元素是F,最高价氧化物对应的水化物酸性最强的是HClO4;
(5)推测Si、N最简单氢化物的稳定性NH3大于SiH4;
(6)原子半径最小的元素是H,原子半径最大的元素是Na;
(7)氢化物最稳定的是HF,氢化物水溶液显碱性的是NH3.
分析 (1)周期数≤最外层电子数的元素为金属元素(H元素除外);金属性最强的元素在周期表的左下角位置,钠和氧气反应可以生成氧化钠和过氧化钠,其最高价氧化物对应水化物是氢氧化钠;
(2)第ⅤⅡA族元素的最高化合价最高,为+7价;
(3)铝既能与HCl反应,又能与NaOH反应,其最高价氧化物Al2O3对应水化物具有两性;
(4)非金属性最强元素的在周期表的右上角位置,为F,F无正价,O无最高正价,Cl的最高价氧化物对应的水化物酸性最强;
(5)非金属性越强,气态氢化物越稳定;
(6)H元素的原子半径最小,原子半径最大的元素在左下方,为Na;
(7)非金属性越强氢化物稳定性越强,唯一的氢化物水溶液显碱性的NH3.
解答 解:(1)周期数≤最外层电子数的元素为金属元素(H元素除外),1-18号元素中,Li、Be、Na、Mg、Al为金属元素,共5种元素;
金属性最强的元素在周期表的左下角位置,钠和氧气反应可以生成Na2O和Na2O2,其最高价氧化物对应水化物是氢氧化钠,
故答案为:5;Na2O;Na2O2;NaOH;
(2)第ⅤⅡA族元素的最高化合价最高,为+7价,而F无正价,
故答案为:Cl;+7;
(3)铝既能与HCl反应,又能与NaOH反应,其最高价氧化物Al2O3对应水化物具有两性,
故答案为:Al;两性;
(4)非金属性最强元素的在周期表的右上角位置,为F,F无正价,O无最高正价,Cl的最高价氧化物对应的水化物HClO4酸性最强,
故答案为:F;HClO4;
(5)非金属性越强,气态氢化物越稳定,非金属性N>Si,则稳定性为NH3>SiH4,
故答案为:NH3;SiH4;
(6)H元素的原子半径最小,原子半径同一周期从左到右依次减小,同一主族从上到下依次增大,故原子半径最大的为Na,
故答案为:H;Na;
(7)非金属性越强氢化物稳定性越强,F的非金属性最强,其氢化物稳定性最强,唯一的氢化物水溶液显碱性的是NH3,
故答案为:HF;NH3.
点评 本题考查位置结构与性质关系的综合应用,题目难度中等,侧重元素在周期表的位置及元素周期律的考查,注意掌握元素周期表的结构、元素周期律内容,试题培养了学生的灵活应用能力.

| A. | 需要加热的化学反应都是吸热反应 | |
| B. | 放热反应都不需要加热就可以发生 | |
| C. | 化学反应除了生成新物质外,还伴随着能量的变化 | |
| D. | 化学反应放热还是吸热,取决于反应条件 |
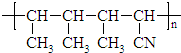 ,该合成高聚物的单体是( )
,该合成高聚物的单体是( )| A. | CH3CH═CHCH3 | B. | CH2═CHCH2CH3 | C. | CH2═CHCH3 | D. | CH3CH═CHCN |
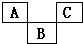 如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )
如图为元素周期表的一部分,A、B、C均为短周期元素.B的最高价氧化物的水化物为H3BO4,则A、B、C依次是( )| A. | C、A1、P | B. | N、Si、S | C. | C、P、O | D. | F、S、Ar |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 非金属元素之间可以形成离子化合物 | |
| C. | 不同元素的原子构成的分子只含极性共价键 | |
| D. | 主族元素的最外层电子数一定等于其最高化合价 |
| A. | 切开的金属Na暴露在空气中,光亮表面逐渐变暗 2Na+O2═Na2O2 | |
| B. | 向Na2CO3溶液中滴加稀盐酸起初没看到气体的生成 CO32-+H+═HCO3- | |
| C. | Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2CO2+2Na2O2═2Na2CO3+O2 | |
| D. | 向NaHCO3溶液中加入过量澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
| A. | 铯与水反应:Cs+H2O═Cs++OH-+H2↑ | |
| B. | 实验室检验氯气:Cl2+2I-═I2+2Cl- | |
| C. | 实验室制氨气:NH4++OH-═H2O+NH3↑ | |
| D. | 氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-═CaSO4↓+H2O |
 、
、
 ;
;