��Ŀ����
����Ŀ��һ���¶��£����ݻ�ΪVL���ܱ������н��з�Ӧ��aN��g���TbM��g����M��N�����ʵ�����ʱ��ı仯������ͼ��ʾ�� 
��1���÷�Ӧ�Ļ�ѧ����ʽ�� ![]() = ��
= ��
��2��t1��t2ʱ��Σ���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ ��
��3��t2ʱ������M������������N�����������ȡ�����ȡ�����
��4��������������˵��������Ӧ�ﵽƽ��״̬���� ��
A.��Ӧ��M��N�����ʵ���֮��Ϊ1��1
B.�������������ʵ�������ʱ��ı仯���仯
C.��λʱ����ÿ����a mol N��ͬʱ����b mol M
D.N�����������ڻ�������б��ֲ��䣮
���𰸡�
��1��2
��2��![]() mol?L��1?min��1
mol?L��1?min��1
��3�������
��4��BD
���������⣺��1����ͼ���֪�� ![]() =
= ![]() =
= ![]() =
= ![]() =2�����Դ��ǣ�2����2��t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��v=
=2�����Դ��ǣ�2����2��t1��t2ʱ�̣���M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ��v= ![]() =
= ![]() =
= ![]() molL��1min��1 �� ���Դ��ǣ�
molL��1min��1 �� ���Դ��ǣ� ![]() molL��1min��1����3��t2ʱ������M������=
molL��1min��1����3��t2ʱ������M������= ![]() =
= ![]() mol/��Lmin��������N������=
mol/��Lmin��������N������= ![]() =
= ![]() mol/��Lmin����t2ʱ������M������������N�����ʲ���ȣ����Դ��ǣ�����ȣ���4��A������ϵ��ƽ��״̬ʱ��M��N�����ʵ���֮��Ϊ����ʱ1��1��Ҳ���ܲ���1��1����A����
mol/��Lmin����t2ʱ������M������������N�����ʲ���ȣ����Դ��ǣ�����ȣ���4��A������ϵ��ƽ��״̬ʱ��M��N�����ʵ���֮��Ϊ����ʱ1��1��Ҳ���ܲ���1��1����A����
B�����ŷ�Ӧ���У��������������ʵ�����С�����������������ʵ�������ʱ��ı仯���仯ʱ��˵������ƽ��״̬����B��ȷ��
C�����۷�Ӧ�Ƿ�ﵽƽ�⣬�����ϵ���dz����ģ���Ӧ����һ�£�������Ϊƽ��״̬�жϵ����ݣ���C����
D��N�����������ڻ�������б��ֲ�����ƽ���־����D��ȷ�����Դ��ǣ�BD��
�����㾫����������Ĺؼ��������ⷴӦ���ʵĶ�����ʾ���������֪ʶ�����շ�Ӧ���ʵĵ�λ��mol/(L��min)��mol/(L��s) v=��c-��t���Լ��Ի�ѧƽ��״̬���жϵ����⣬�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�

����Ŀ����ͨ����н�������ʵ�飺
���� |
|
| |
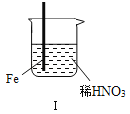
���� | Fe�������������ɫ���ݣ�Һ���Ϸ���Ϊ����ɫ | Fe���������������ɫ���ݺ�Ѹ��ֹͣ | Fe��Cu�Ӵ�����������������ɫ���� |
����˵������ȷ���ǣ�������
A. ������������ɫ�����ɫ�Ļ�ѧ����ʽ��2NO+O2�T2NO2
B. ���е�����˵��Fe�����γ����ܵ������㣬��ֹFe��һ����Ӧ
C. �Դ���������˵��ϡHNO3��������ǿ��ŨHNO3
D. �������������Fe��Cu֮�����ӵ����ƣ����ж�Fe�Ƿ�����
����Ŀ��̼���������ĵ��ʼ��仯�����ڹ�ũҵ����������������Ҫ��;��
��1�����̼�Ȼ�ԭһ��������ʵ���������Ʊ�������������ص��Ȼ�ѧ����ʽ���£�
Al2O3��s��+AlC13��g��+3C��s���T3AlCl��g��+3CO��g����H=a��kJmol��1
3AlCl��g���T2Al��l��+AlC13��g����H=b��kJmol��1
�ú�a��b�Ĵ���ʽ��ʾ��Ӧ��Al2O3��s��+3C��s��=2Al��l��+3CO��g������H=_____kJmol��1��
��2���û���̿��ԭ�����Դ����������ij�о�С����ij�ܱ������м���һ�����Ļ���̿��NO��������ӦC��s��+2NO��g��N2��g��+CO2��g����H=Q��kJmol��1����T1��ʱ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�ʱ�䵥λΪmin,Ũ�ȵ�λΪmol/L����
| 0 | 10 | 20 | 30 |
NO | 1.00 | 0.68 | 0.50 | 0.50 |
N2 | 0 | 0.16 | 0.25 | 0.25 |
CO2 | 0 | 0.16 | 0.25 | 0.25 |
��0��10min�ڣ�NO��ƽ����Ӧ����v��NO��=_____��T1��ʱ���÷�Ӧ��ƽ�ⳣ��K=_____��
��30min�������¶���T2�����ﵽƽ��ʱ��������NO��N2��CO2��Ũ��֮��Ϊ3��1��1����Q_____0�����������������������T����
���ں��������£����жϸ÷�Ӧһ���ﵽ��ѧƽ��״̬��������_____������ѡ���ţ���
a����λʱ��������2nmolNO��g����ͬʱ����nmolCO2��g��
b����Ӧ��ϵ��ѹǿ���ٷ����ı�
c�����������ܶȱ��ֲ���
d����������ƽ����Է����������ֲ���
����������������Ӧǰ30min�ķ�Ӧ�������䣬��ʼʱNO��Ũ��Ϊ2.50mol/L����Ӧƽ��ʱc��NO��=_____mol/L��NO��ת����_____������������������С����������������
��3��ֱ���ŷ�úȼ�ղ������������������صĻ������⣬��ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ģ���ͼ��ͨ���˹�������ã���CO2��H2OΪԭ���Ʊ�HCOOH��O2��ԭ��ʾ��ͼ���缫b���淢���ĵ缫��ӦʽΪ_____��