题目内容
【题目】A、B、C、D、E、F、G为七种短周期主族元素,原子序数依次增大。已知:A、F的最外层电子数分别等于各自的电子层数,其中A的单质在常温下为气体。C与B、G在元素周期表中处于相邻位置,这三种元素原子的最外层电子数之和为17,质子数之和为31。D与F同周期,且在该周期中D元素的原子半径最大。下列说法不正确的是( )
A. C、D、G三种元素形成的盐,水溶液可能呈碱性
B. A与B能形成离子化合物A5B,且既含有离子键又含有共价键
C. B、C、G的简单氢化物中C的氢化物稳定性最强
D. D、E、F、G形成的简单离子半径逐渐减小
【答案】D
【解析】A、F的最外层电子数分别等于各自的电子层数(符合要求的是H、Be、Al),其中A的单质在常温下为气体,则A为H,根据原子序数依次增大,得到F只能是Al。D与F同周期,且在该周期中D元素的原子半径最大,则D为Na。由此可得:C与B、G在元素周期表中处于相邻位置时,只能是B、C处于同周期相邻主族,C、G处于同主族相邻周期。这三种元素原子的最外层电子数之和为17,得到B最外层5个电子,C、G最外层都是6个电子。所以B、C、G分别为N、O、S。即A、B、C、D、E、F、G七种元素分别为:H、N、O、Na、Mg、Al、S。 C、D、G三种元素形成的盐可能为Na2SO3,溶液显碱性,选项A正确。A与B能形成离子化合物A5B(即NH4H),电子式为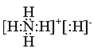 ,所以既含有离子键又含有共价键,选项B正确。B、C、G中C(即O元素)的非金属性最强,所以C的氢化物稳定性最强,选项C正确。D、E、F、G形成的简单离子(Na+、Mg2+、Al3+、S2-、Cl-),按照核外电子排布,前三个离子有两个电子层,后两个离子有三个电子层,所以后两个离子半径更大,选项D错误。
,所以既含有离子键又含有共价键,选项B正确。B、C、G中C(即O元素)的非金属性最强,所以C的氢化物稳定性最强,选项C正确。D、E、F、G形成的简单离子(Na+、Mg2+、Al3+、S2-、Cl-),按照核外电子排布,前三个离子有两个电子层,后两个离子有三个电子层,所以后两个离子半径更大,选项D错误。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为______________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是______(填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。

①滴定醋酸的曲线是_________(填“I”或“Ⅱ”)。
②滴定开始前,三种溶液中由水电离出的c(H+)最大的是_______。
③V1和V2的关系:V1___V2(填“>”、“=”或“<”)。
④M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2mL0.005mol/LAgNO3溶液中加入2mL0.005mol/L KSCN溶液,静置。 | 出现白色沉淀 |
步骤2:取1mL上层清液于试管中,滴加1滴2mol/LFe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
①写出步骤2中溶液变红色的离子方程式_____________。
②步骤3中现象a是_____________。
③用化学平衡原理解释步骤4的实验现象___________。