题目内容
【题目】工业生产以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为: 2NH3(g)+CO2(g) ![]() CO(NH2)2 (l)+H2O (l)。
CO(NH2)2 (l)+H2O (l)。
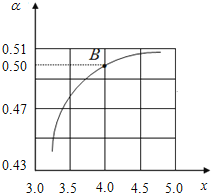
(1)T1℃时,在2L的密闭容器中充入NH3和CO2模拟工业生产,若原料气中的NH3和CO2的物质的量之比(氨碳比)![]() =x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
=x,如图是CO2平衡转化率(α)与氨碳比(x)的关系。其它条件不变时,α随着x增大而增大的原因是__________________.
(2)当x=2,上述反应至5min时各物质的浓度不再发生变化,若起始的压强为P0KPa,测得平衡体系压强变为起始时的![]() 。反应结束后,分离得到90g尿素。
。反应结束后,分离得到90g尿素。
试计算该反应的平均速率υ(CO2)=________________,该反应的平衡常数K=___________,达到平衡后NH3的物质的量浓度为______________。
【答案】 x增大,相当于c(NH3)增大,CO2转化率增大 0.15 mol·L-1·min-1 0.074 3 mol·L-1
【解析】(1)增大反应物浓度,平衡正向进行,α随着x增大而增大的原因是:x增大,相当于c(NH3)增大,CO2转化率增大;(2)当x=2,原料气中的NH3和CO2的物质的量之比为2,设二氧化碳物质的量为a,氨气物质的量为2a,上述反应至5min时各物质的浓度不再发生变化,反应达到平衡状态,测得体系压强变为开始时的2/3,气体压强之比等于气体物质的量之比,反应结束后,分离得到90g尿素,物质的量n(CO(NH2)2 )=90g/60g·mol-1=1.5mol,消耗氨气物质的量为3mol,消耗二氧化碳物质的量为1.5mol,利用化学平衡三行计算列式计算,
2NH3(g)+CO2(g)![]() CO(NH2)2 (l)+H2O(l),
CO(NH2)2 (l)+H2O(l),
起始量/mol 2a a 0 0
变化量/mol 3 1.5 1.5 1.5
平衡量/mol 2a-3 a-1.5 1.5 1.5
测得体系压强变为开始时的2/3,气体压强之比等于气体物质的量之比,2a-3+a-1.5=2/3×(2a+a)a=4.5mol,二氧化碳反应速率V=△c/△t=1.5mol/(2L×5min)=0.15mol·L-1·min-1,平衡时氨气的浓度=(2×4.5mol-3mol)/2L=3mol·L-1,CO2的浓度=(4.5mol-1.5mol)/2L=1.5mol·L-1,平衡常数K=1/(33×1.5)=0.074,达到平衡后NH3的物质的量浓度=(2×4.5mol-3mol)/2L=3mol·L-1。

