题目内容
下列过程中不涉及氧化还原反应的是
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
D
解析试题分析:A、植物油与氢气的加成反应制备人造黄油,H的价态变化,错误;B、发生反应:2FeCl3+Cu=2FeCl2+CuCl2,错误;C、牺牲阳极的阴极保护法阳极金属发生氧化反应,错误;D、蛋白质溶液中加入饱和硫酸铵溶液发生盐析,是物理变化,正确。
考点:铁元素及其化合物性质、油脂、蛋白质的性质、化学防腐知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为了实现下列各变化,需加入还原剂的是
| A.KClO3→O2 | B.NH4+→NH3 | C.Fe→FeCl3 | D.CO2→CO |
已知:①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液。
下列判断正确的是
| A.上述实验中,共涉及四个氧化还原反应 |
| B.实验可证明还原性:H+>Fe2+>OH->I- |
| C.实验②可证明溶解度:Fe(OH)3>Fe(OH)2 |
| D.实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
反应①和②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2。下列说法正确的是
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42->IO3->I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1︰5 |
三氟化氮(NF3)是一种无色无味的气体,它是氨和氟(F2)在一定条件下直接反应得到:4NH3+3F2=NF3+3NH4F,下列有关NF3的叙述正确的是( )
| A.NF3的氧化性比F2强 |
| B.NF3的还原性比NH3强 |
| C.NF3中的原子最外层均达8电子 |
| D.该反应过程转移了6 mol电子。 |
制备食用碘盐(KIO3)原理之一为:I2 +2KClO3 Cl2 +2KIO3,下列说法正确的是
Cl2 +2KIO3,下列说法正确的是
| A.KClO3和KIO3均属于离子化合物,只含有离子键 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>Cl |
| C.为防止反应的尾气造成大气污染,可以用饱和食盐水吸收尾气 |
| D.制备KIO3的反应中I2被氧化 |
已知P单质在KOH溶液中的变化是:4P+3KOH+3H2O=3KH2PO2+PH3↑,下列说法正确的是
| A.产物PH3分子中所有的原子可能共平面 |
| B.该反应中P做还原剂,H2O做氧化剂 |
| C.相关元素的第一电离能的大小顺序:S>P>Si |
| D.该反应每发生0.3摩尔电子转移,PH3分子中就有0.3摩尔P-H键形成 |
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:
已知:
①2Ni2O3(黑色)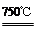 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑
②
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
根据信息回答:
(1)28Ni在周期表中的第 周期;镍与稀硝酸反应的离子方程式为 。实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃ 时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为 ;
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3。为了得到纯净的溶液B还需要加入以下物质 进行除杂(填正确答案标号)。
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O。则操作I、II名称是 、 ; D生成E的化学方程式为 。
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol。
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量。已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀。从实验误差角度分析主要原因为: 。