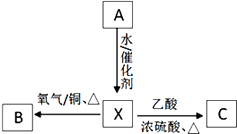
题目内容
【题目】下列说法规范的是( )
A. 98g稀硫酸所含分子数为1mol B. 氧的摩尔质量为32g/mol
C. 某硫酸溶液中H2SO4的质量分数为60% D. 标准状况下,1mol气体的体积约为22.4L/mol
【答案】C
【解析】A项,98g稀硫酸中硫酸的质量分数未知,无法计算溶液中分子物质的量,错误;B项,没有指明是氧分子还是氧原子,不规范;C项,某硫酸溶液中H2SO4的质量分数为60%,规范;D项,单位不正确,标准状况下1mol气体的体积约为22.4L,不规范;答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目