题目内容
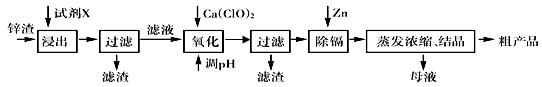
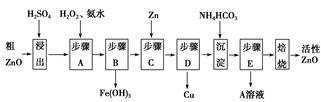
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如表:
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。

已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。
(1)2Fe2++H2O2+2H+=2Fe3++2H2O 3.2~5.2 (2)(NH4)2SO4 (3)> (4)0.78
(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+便于除去,同时不引入新的杂质。由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2~5.2之间。
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵。
(3)反应自发,且ΔH>0,则ΔS必大于0。
(4)由c(Zn2+)×c2(OH-)=Ksp
c(Zn2+)=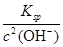 =
=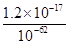 =1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵。
(3)反应自发,且ΔH>0,则ΔS必大于0。
(4)由c(Zn2+)×c2(OH-)=Ksp
c(Zn2+)=
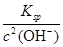 =
=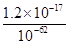 =1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
=1.2×10-5(mol·L-1),即1.2×10-5 mol·L-1×65 g·mol-1=7.8×10-4g·L-1,即0.78 mg·L-1
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816