题目内容
【题目】对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
C.Cl2既做氧化剂又做还原剂
D.氧化剂得电子数与还原剂失电子数之比为5∶1
【答案】C
【解析】对于反应3Cl2+6NaOH ![]() 5NaCl+NaClO3+3H2O,,氯元素的化合价升高到+5价,发生氧化反应共有1摩尔氯原子被氧化;氯元素的化合价降低到-1价,发生还原反应,共有5摩尔氯原子被还原;因此,氯气Cl2既做氧化剂又做还原剂,答案C正确;B.被氧化的氯原子和被还原的氯原子的物质的量之比为1∶5,B错误;D. 氧化剂得电子数与还原剂失电子数之比为1:1,D错误;
5NaCl+NaClO3+3H2O,,氯元素的化合价升高到+5价,发生氧化反应共有1摩尔氯原子被氧化;氯元素的化合价降低到-1价,发生还原反应,共有5摩尔氯原子被还原;因此,氯气Cl2既做氧化剂又做还原剂,答案C正确;B.被氧化的氯原子和被还原的氯原子的物质的量之比为1∶5,B错误;D. 氧化剂得电子数与还原剂失电子数之比为1:1,D错误;
所以答案是:C

【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 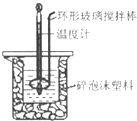
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
【题目】在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g) ![]() CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是;
A.容器中压强不变
B.混合气体中c(CO)不变
C.v逆(H2)=v正(H2O)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,在此温度下,若该容器中含有1molCO2、1.2molH2、0.75molCO、1.5molH2O,这状态(是或否)处于平衡状态?若不是,反应向哪个方向进行? . (选填“向正反应方向”、“向逆反应方向”).
(4)若830℃时,向容器中充入lmolCO、5molH2O,反应达到平衡后,CO的转化率为 .
【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见下表(表中t2>t1):
反应时间/min | N(CO)/mol | H2O/mol | N(CO2)/mol | N(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)= ![]() mol?L﹣1?min﹣1
mol?L﹣1?min﹣1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol
