题目内容
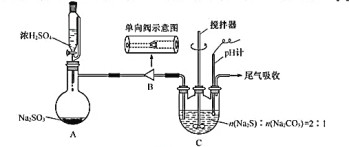
【题目】现用质量分数为98%、密度为1.84 g·cm-3的浓H2SO4来配制500 mL、0.2 mol·L-1的稀H2SO4。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有__________(填代号)。
(2)经计算,需浓H2SO4的体积为____________。现有①10 mL ②50 mL ③100 mL三种规格的量筒,你选用的量筒是__________(填代号)。
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到__________ mL的容量瓶中,转移时应用玻璃棒__________。转移完毕,用少量蒸馏水洗涤__________2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度__________处。改用__________加蒸馏水到瓶颈刻度的地方,使溶液的__________。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作中:错误的是_______,能引起误差偏高的有______(填代号)。
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
【答案】②⑦⑧ 5.4mL ① 500 引流 烧杯、玻璃棒 1 cm~2 cm 胶头滴管 凹面正好跟刻度相平 ①②③④⑥⑦ ①②⑦
【解析】
(1)配制溶液的步骤,以及每一步所对应需要的仪器,因为是由浓硫酸稀释变为稀硫酸,所以配制过程中不需要的仪器有烧瓶、托盘天平、 药匙;
(2)根据稀释定律,稀释前后硫酸的物质的量不变,计算出所需浓硫酸的体积为5.4mL,选择对应的量取工具,减小实验误差,因此选用量程为10mL的量筒;
(3)误差c(H2SO4)= ![]() ,n(H2SO4)偏小或V(溶液)偏大,则c(H2SO4)偏小;n(H2SO4)偏大或V(溶液)偏小,则c(H2SO4)偏大。
,n(H2SO4)偏小或V(溶液)偏大,则c(H2SO4)偏小;n(H2SO4)偏大或V(溶液)偏小,则c(H2SO4)偏大。
(1)依据配制一定物质的量浓度溶液的一般步骤:计算、称量或量取、溶解、冷却、移液、定容、摇匀等,用到的玻璃仪器有:烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管,不需要的仪器有②烧瓶、⑦托盘天平、 ⑧药匙;
答案:②⑦⑧;
(2)质量分数为98%、密度为1.84g.cm-3的浓H2SO4的物质的量浓度为:![]() mol/L=18.4mol/L,设需要浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质的物质的量不变,则VmL×18.4molL-1=500mL×0.2molL-1,解得:V=5.4mL,选用量筒的规格为10mL;
mol/L=18.4mol/L,设需要浓硫酸的体积为VmL,根据稀释定律,稀释前后溶质的物质的量不变,则VmL×18.4molL-1=500mL×0.2molL-1,解得:V=5.4mL,选用量筒的规格为10mL;
答案:5.4mL;①;
(3)配制500mL0.2 mol·L-1的稀H2SO4需要500mL容量瓶;转移时应用玻璃棒引流,转移完毕,玻璃棒、烧杯壁上沾有少量的硫酸,为减少误差需要洗涤,并将洗涤液移入容量瓶,当蒸馏水滴加到液面接近刻度1~2cm处,为便于控制改用胶头滴管加蒸馏水,到瓶颈刻度的地方,使溶液的凹面正好跟刻度线相平;
答案:500 ; 引流 ; 烧杯、玻璃棒 ; 1cm~2cm ; 胶头滴管 ; 凹面正好跟刻度相平。
(4)①量取浓硫酸的量筒不能洗涤,如果洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致量取的浓硫酸体积偏大,配制的硫酸的浓度偏高;
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,热的溶液体积偏大,冷却后溶液体积变小,导致配制的溶液体积偏小,配制的硫酸的浓度偏高;
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸,会造成液滴四溅,稀释浓硫酸时,应该将浓硫酸沿烧杯内壁缓缓加入水中,并用玻璃棒搅拌,顺序不能颠倒;
④定容时,加蒸馏水超过标线,又用胶头滴管吸出,吸出的溶液中含有溶质,导致溶质的物质的量偏小,配制的硫酸的浓度偏低;
⑤转移前,容量瓶中含有少量蒸馏水,对溶质的物质的量及溶液体积没有影响,不影响配制结果;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,导致配制的溶液体积偏大,配制的硫酸的浓度偏低;
⑦定容时,俯视标线,导致加入的蒸馏水体积偏小,配制的溶液体积偏小,配制硫酸的浓度偏高;
答案是:①②③④⑥⑦;①②⑦。