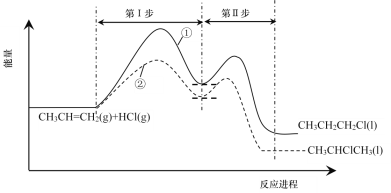
题目内容
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. H2SO4加入Ba(OH)2溶液中:Ba2++SO42-=BaSO4↓
D. 盐酸酸化的H2O2加入FeSO4溶液中:Fe2++H2O2+2H+= Fe3++2H2O
【答案】B
【解析】A、次氯酸是弱酸;B、氢氧化铝是两性氢氧化物不溶于弱酸弱碱;C、硫酸和氢氧化钡反应生成硫酸钡和水;D、选项中离子方程式电荷不守恒。
A、次氯酸是弱酸,应该用化学式表示,正确的应该是Cl2+H2O![]() H++Cl-+HClO ,选项A错误,;B、氢氧化铝是两性氢氧化物,但不能溶于弱碱氨水中,选项B正确;C、硫酸和氢氧化钡反应生成硫酸钡和水,而水不能拆,故离子方程式为2OH-+2H++Ba2++SO42-=BaSO4↓+2H2O,选项C错误;D、选项中离子方程式电荷不守恒,向酸性FeSO4溶液中滴入H2O2,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,选项D错误;答案选B。
H++Cl-+HClO ,选项A错误,;B、氢氧化铝是两性氢氧化物,但不能溶于弱碱氨水中,选项B正确;C、硫酸和氢氧化钡反应生成硫酸钡和水,而水不能拆,故离子方程式为2OH-+2H++Ba2++SO42-=BaSO4↓+2H2O,选项C错误;D、选项中离子方程式电荷不守恒,向酸性FeSO4溶液中滴入H2O2,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,选项D错误;答案选B。

练习册系列答案
相关题目
【题目】已知:H2(g)+Br2(l)=2HBr(g) H=-akJ/mol,蒸发1molBr2(l)需要吸收的能量为30kJ,其他数据如下表:
H2(g) | Br2(g) | HBr(g) | |
1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | b | 369 |
下列说法正确的是
A. 2HBr(g)=H2(g)+Br2(g)H=+akJ/mol
B. H2(g)的稳定性低于HBr(g)
C. Br2(g)=Br2(l) H=+30kJ/mol
D. b=272-a