题目内容
【题目】亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:

已知:①ClO2气体只能保持在浓度较低状态下以防止爆炸性分解,且需现合成现用。
②ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应式 。
(2)反应生成ClO2气体需要X酸酸化,X酸可以为 。
A.盐酸 B.稀硫酸 C.硝酸 D.H2C2O4溶液
(3)吸收塔内的温度不能过高的原因为 。
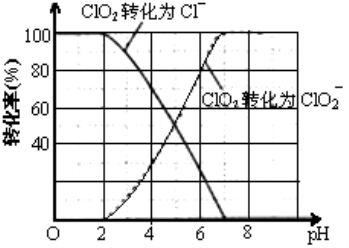
(4)ClO2被S![]() 还原为ClO
还原为ClO![]() 、Cl
、Cl![]() 转化率与pH关系如图。写出pH≤2时ClO2与S
转化率与pH关系如图。写出pH≤2时ClO2与S![]() 反应的离子方程式: 。
反应的离子方程式: 。
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN![]() 等有明显的去除效果。某工厂污水中含CN
等有明显的去除效果。某工厂污水中含CN![]() amg/L,现用ClO2将CN
amg/L,现用ClO2将CN![]() 氧化,生成了两种无毒无害的气体,其离子反应方程式为______________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
氧化,生成了两种无毒无害的气体,其离子反应方程式为______________;处理100 m3这种污水,至少需要ClO2 _____________ mol。
【答案】
(1)Cl--6e-+3H2O=ClO3-+6H+(2)B
(3)温度过高H2O2将分解
(4)2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(5)2ClO2+2CN-=2Cl-+2CO2+N2↑;![]() ;
;
【解析】
试题分析:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl--6e-+6OH-=ClO3-+3H2O,故答案为:Cl--6e-+6OH-=ClO3-+3H2O;
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸;故答案选:B;
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解;故答案为:温度过高H2O2将分解;
(4)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(5)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为![]() mol,故答案为:2ClO2+2CN-=2Cl-+2CO2+N2↑;
mol,故答案为:2ClO2+2CN-=2Cl-+2CO2+N2↑;![]() 。
。

 习题精选系列答案
习题精选系列答案